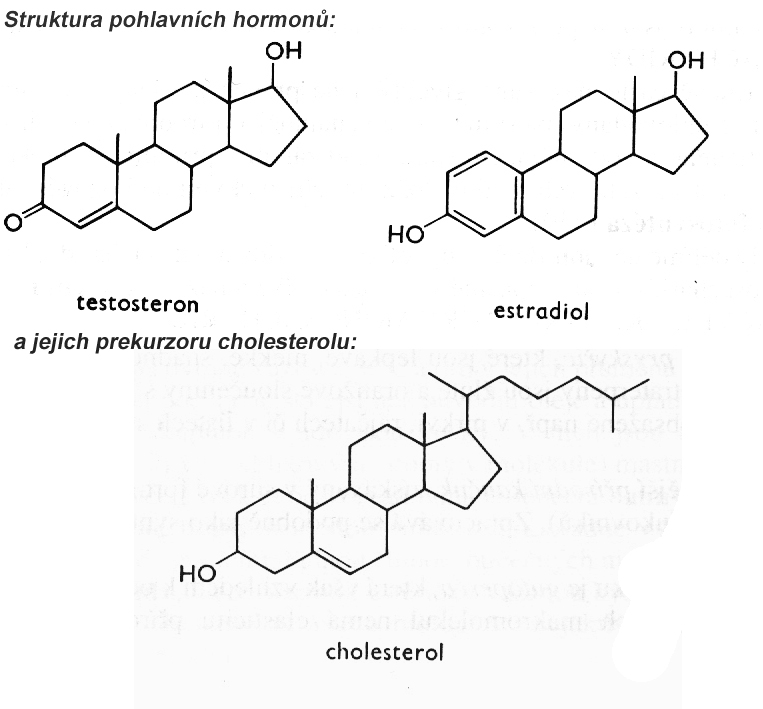
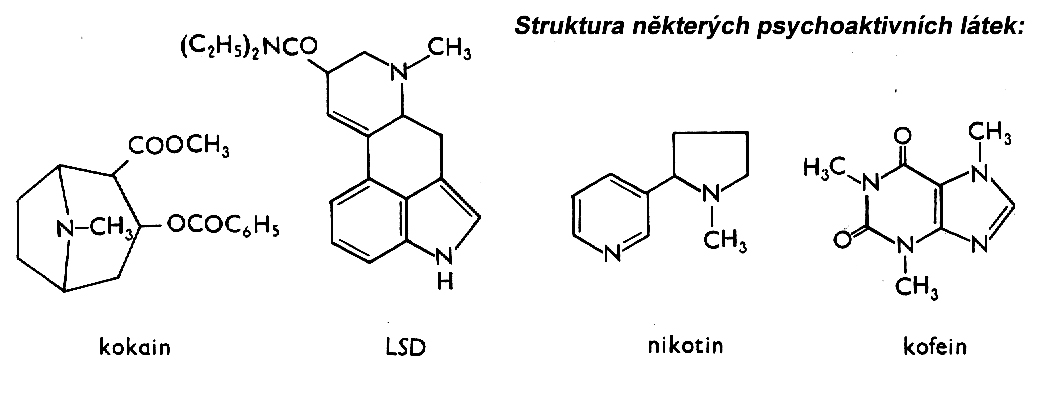
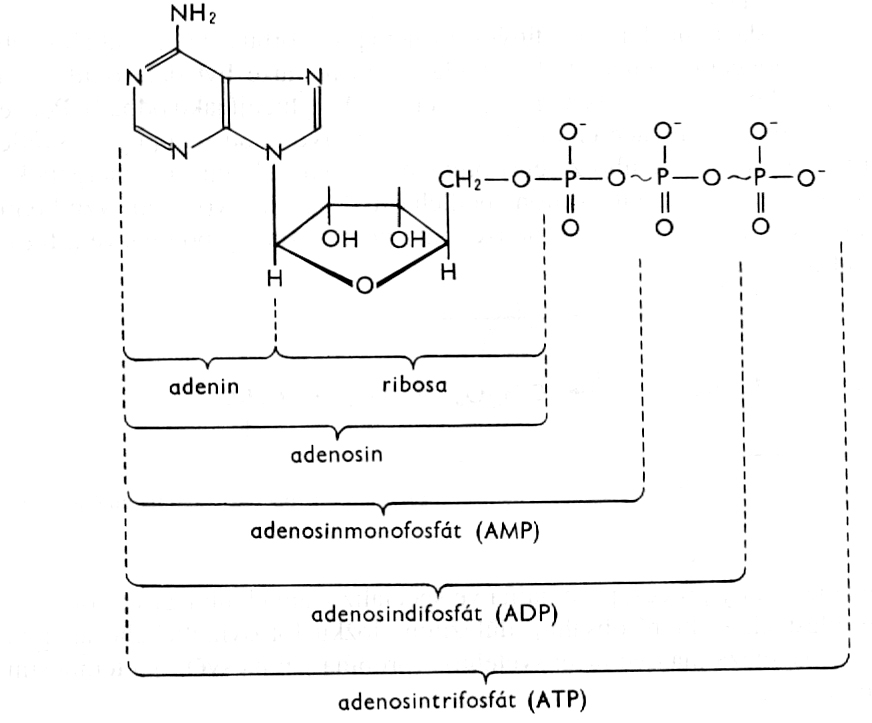
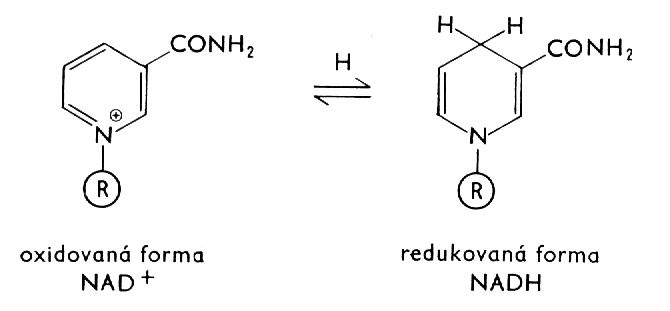
2.1 Středoškolská chemie - Úvod
Tato kapitola má připomenout ty základy středoškolské chemie, které budete potřebovat,
abyste na ně mohli navázat při snaze o hlubší pochopení
fungování živých organismů na základě příjmu a výdeje jednotlivých chemických látek (prvků nebo sloučenin),
pochopení metabolických procesů, jako kaskád chemických reakcí vedoucích především k transformacím
chemických sloučenin a energie vázané v těchto sloučeninách v rámci chemických vazeb -
a využitím této energie pro životní procesy organismů.
Nutnou součástí je pochopení složení a stavby hmoty jako takové, pochopení možnosti poutání energie v rámci hmoty -
konkrétně v jednotlivých chemických sloučeninách a jejich vazbách, porozumění základním možnostem přeměn jednotlivých chemických sloučenin v rámci chemických reakcí.
2.2 Hmota a její struktura
Hmota má dualistický - vlnový i částicový charakter. O (fyzikálních) polích mluvíme v případě, že převládá vlnový charakter a zahrnujeme k nim pole elektrické, elektromagnetické, magnetické, gravitační… Pole jsou schopná zprostředkovat vzájemné působení jednotlivých těles, látek, částic…
U záření elektromagnetického pole jsou jeho vlastnosti dané částí spektra vlnových délek - mikrovlnná část (10-9 až 10-6 nm), infračervené (10-6 až 10-3 nm), viditelné (10-3 až 10-2nm), ultrafialové (10-2 nm), rentgenové, gama záření (radioaktivní).
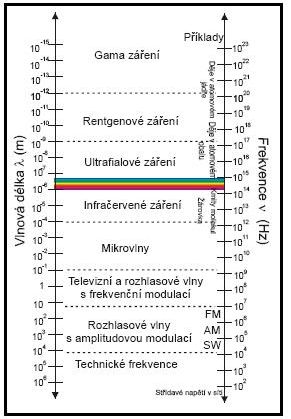
(převzato z webu Fyzweb.cz)
Látky jsou formy hmoty s částicovým charakterem (složené z atomů, iontů, molekul…). Konkrétní formy hmoty mají schopnost setrvávat ve svém okamžitém stavu (hmotnost) a při interakci s okolím měnit jeho i svůj stav (konat práci).
Zákon zachování hmoty:
Zákon zachování energie:
Prvek
je typ látky chemicky čisté, tvořené atomy se stejným protonovým číslem (ať už v molekulách, krystalové mřížce, nebo volných). Prvky mohou obsahovat různé izotopy (stejné protonové číslo, různé nukleonové číslo), nebo může jít o nuklidy (stejné protonové i nukleonové číslo).
Sloučenina
je typ látky tvořené jedním typem iontů nebo molekul (2 nebo více různých atomů v molekulách je spojených chemickou vazbou). Sloučeniny nebo prvky mají charakteristické fyzikální a chemické vlastnosti (teplota tání, varu, hustotu).
Směsi
jsou typy látek tvořené různými chemicky čistými látkami, rozptýlenými v rámci celého objemu. Vlastnosti směsi záleží na jejím složení, velikosti jednotlivých částic, jejich vzájemném rozmístění. Rozdělení směsí je podle velikosti rozptýlených částic a podle jejich skupenství.
Podle velikosti rozptýlených částic dělíme směsi na homogenní (částice ve velikosti nanometru), koloidní (velikost desítek až stovek nanometrů) a heterogenní (částice velikosti desetiny mikrometru a větší).
Obsahuje-li směs jednu látku spojitou v celém prostředí a obsahující rozptýlené látky ostatní, mluvíme o disperzním prostředí a dispergované látce.
Podle skupenství pak rozdělujeme směsi na aerosoly (mlha, dým, prach, kouř), pěny (bublinky plynu rozptýlené v kapalině), roztoky (plynné, kapalné, pevné (slitiny)), koloidní roztoky (na rozdíl od pravých roztoků tvořené nikoli jednotlivými atomy a molekulami, ale jejich shluky a ionty), emulze (kapičky kapaliny rozptýlené v jiné kapalině), suspenze (pevné částice nebo krystaly rozptýlené v kapalině), gely (dispergované částice propojené v jeden celek v kapalině) a inkluze (bublinky plynu rozptýlené v pevné látce).
2.3 Atom
Termín označující základní stavební částice látek, pocházející z Řecka (atomos = nedělitelný) - běžnými chemickými prostředky nejde dělit. Teprve na začátku 20 století se ukázalo, že atomy se skládají z kladně nabitého jádra (tvořícího většinu hmotnosti atomu) a elektronového obalu (E. Rutherford) tvořeného záporně nabitými elektrony (náboj -1,602.10-19 C).
Jádro je tvořeno dvěma druhy částic - protony a neutrony (souhrnně nukleony). Počet nukleonů v jádře se nazývá nukleonové (hmotnostní číslo) A. Počet protonů v jádře udává protonové (atomové) číslo Z- vzhledem k elektroneutralitě celého atomu je počet elektronů totožný.
Prvky se stejným protonovým číslem, ale různým počten neutronů se nazývají izotopy (stejné místo v periodické tabulce). Mají v důsledku stejného protonového a elektronového čísla stejné chemické vlastnosti, ale v důsledku mírně odlišných hmotností mohou mít různé rychlosti chemických reakcí (např. tzv. těžký vodík), případně různou intenzitu příjmu živými organismy. Velká část prvků v přírodě jsou směsí izotopů, z nichž jeden výrazně převažuje. Podíl jednotlivých izotopů může být u některých prvků stálý, u jiných se měnit (např. podle různého geologického původu).
Rutherfordův (1911) model atomu - tzv. planetární model - elektrony pohybující se po kružnicích kolem jádra- přičemž velkou většinu hmotnosti tvoří jádro.
Bohrův (1913) model atomu - Energie elektronu se může měnit pouze po určitých celých množstvích energie - kvantech. Elektron je schopný existovat jen ve stavech s určitou energií a tuto energii mění nespojitě (skokově). 1932 objeveny neutrony (Chadwick J.).
Kvantově mechanický model atomu. Tento model popisuje stav částic pomocí vlnových funkcí (řešení pomocí Schroedingerovy rovnice (1926). Vychází z předpokladu, že mikročástice mají duální charakter (chovají se částečně jako částice, částečně mají charakter vlnění). Proto je tento model pravděpodobnostní - nelze změřit ani vypočítat přesné dráhy elektronů, hovoří se (i vzhledem k jejich rychlému pohybu kolem jádra) o tzv. hustotě elektronů - pravděpodobnosti výskytu v určité části obalu.
Současný model:
Ve středu atomu je atomové jádro obsahující tzv. nukleony (tvoří naprostou většinu hmotnosti atomu): protony jsou kladně nabité částice, zhruba 1836krát hmotnější než elektrony, neutrony jsou elektricky neutrální částice, obdobné hmotnosti jako protony. Elektrony jsou záporně nabité částice, které se nacházejí v atomovém obalu, ze kterého je lze relativně snadno vyjmout a vytvořit tím nabitý iont. Elektrony jsou k atomovému jádru vázány elektromagnetickou silou zprostředkovávanou fotony. Protony a neutrony v jádře jsou navzájem vázány silnou jadernou silou zprostředkovanou gluony.
Při experimentech v urychlovačích objeveny další částice: Leptony jsou elektron a neutrino, každý ve třech generačních variantách (elektron, mion a tauon; a neutrino elektronové, mionové a tauonové). Každý lepton má svou antičástici, v případě elektronu je to pozitron. Leptony nemají podle současného poznání vnitřní strukturu. Všechny podléhají slabé interakci. Elektron, mion a tauon mají stejný jednotkový elektrický náboj a interagují elektromagneticky.
Kvarky jsou stavební částice hadronů (např. protonu nebo mezonů). Existuje jich šest (každý se svým antikvarkem), stejně jako u leptonů ve třech generacích. Podléhají všem známým základním interakcím (silná, slabá, elektromagnetická). Jejich elektrický náboj je ±1/3 náboje elektronu. Kvarky se za běžných okolností nikdy nevyskytují samostatně, ale vždy ve složitějších objektech z více než jednoho kvarku. Vzhledem k tomu má tvrzení o existenci kvarků jako částic dosti specifický význam.
K běžným chemickým reakcím ale dochází na úrovni atomu v rámci uvolnění, poutání nebo sdílení elektronů z elektronového obalu atomu. Předpokládaná dráha, po které se pohybují elektrony o určité energetické hladině, nezávisle na ostatních elektronech, se nazývá orbital. Dráha elektronu a jeho energetická hladina se popisují kvantovými čísly.
Hlavní kvantové číslo n udává energii elektronu v atomu - ve vztahu ke vzdálenosti dráhy elektronu od jádra (nulová hodnoty v případě, že jádro a elektron jsou od sebe tak vzdálené, že na sebe navzájem nepůsobí) a molární energie elektronů roste s rostoucím n. Elektrony se stejným n obíhají na stejné energetické hladině. Př. elektrony orbitalů 2s a 2p mají stejné hlavní kvantové číslo.
Vedlejší kvantové číslo l bývá také označováno písmeny (s, p, d, f) a udává předpokládaný tvar orbitalu (dráhy pohybu elektronu kolem jádra).
Magnetické kvantové číslo m se mění od -1 do +1 a udává směr trajektorie elektronu. Elektrony se stejným n, l, m obíhají v rámci stejného orbitalu (v každém orbitalu maximálně 2 elektrony).
Spinové kvantové číslo s udává směr rotace elektronu.
Výstavbový princip:Nejprve se zaplní orbitaly s nižší energetickou hladinou, teprve pak orbitaly s vyšší energetickou hladinou.
Pauliho pravidlo: Každý orbital charakterizovaný kvantovými čísly (n,m,l) může být zaplněn jen 2 elektrony.
Hundovo pravidlo: orbitaly se stejnou energií se obsazují všechny nejprve po jednom elektronu, poté se doplňují na 2 elektronem s opačným spinovým číslem.
Pro obsazování orbitalů elektrony je rozhodující součet hlavního (n) a vedlejšího (l) kvantového čísla , teprve pak velikost hlavního kvantového čísla n. Přednostně se obsadí orbital, u něhož je součet n + l menší. Z orbitalů se stejným součtem n + l se jako první zaplní ten s menším hlavním kvantovým číslem. (Pořadí: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d…)
Pokud se elektrony pohybují po orbitalech s nejmenší možnou energií, atom je v základním stavu. Pokud se po dodání energie pohybují po orbitalech s vyšší energií - atom je v excitovaném stavu (který je však nestabilní).
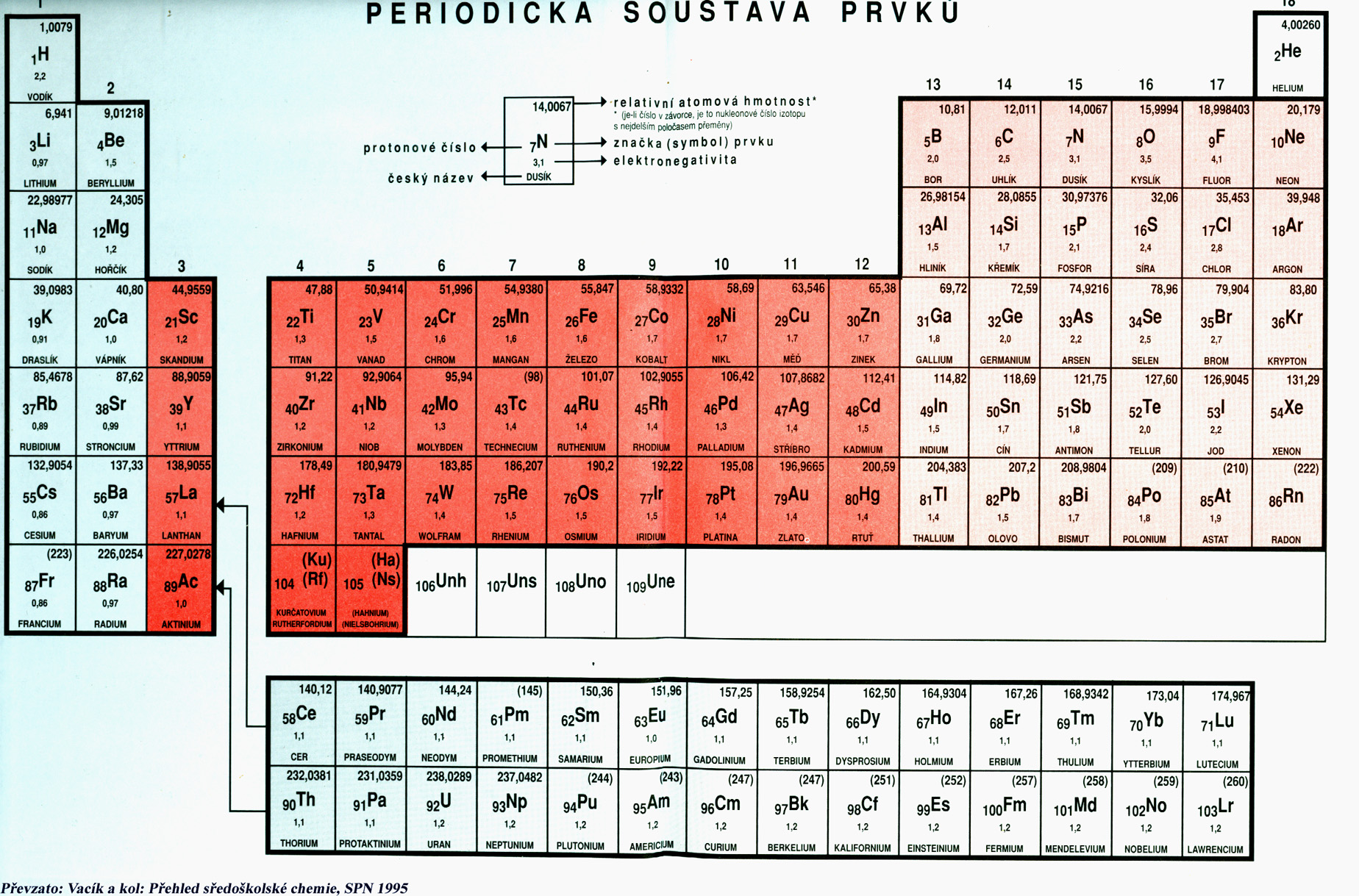
2.4 Periodická (Mendělejevova) tabulka prvků
Je uspořádáním všech chemických prvků do tabulky podle jejich rostoucího protonového čísla (původně podle relativní atomové hmotnosti), a dále podle jejich cyklicky se opakujících charakteristik. V tabulce je obvykle kromě chemického symbolu prvku uvedeno i jeho protonové číslo, relativní atomová hmotnost, elektronegativita (název). V současné době je v tabulce 117 známých prvků, z nichž 94 se přirozeně vyskytuje, a zbylé byly připraveny uměle. Základem uspořádání prvků je jejich seskupení v řádcích (periodách) podle stoupajícího protonového čísla a ve sloupcích (skupinách) podle počtu valenčních elektronů (8 sloupců). Platí, že prvky, nacházející se ve stejné skupině vykazují podobné chemické vlastnosti. Skupiny dále rozděleny na A –základní (s a p valenční orbitaly) a B -přechodné (d valenční orbital).
IA.Skupina - Alkalické kovy - (spolu s vodíkem) mají vždy pouze jeden valenční elektron v orbitalu s. Jsou velmi reaktivní (přirozeně v přírodě jen ve sloučeninách) a jejich reaktivita stoupá s protonovým číslem. Jsou lehké, lesklé měkké (nejtvrdší je lithium), vodivé. Li, Na, K - lehčí než voda (prudce s ní reagují, uchovávají se v petroleji, argonu, nebo inertním uhlovodíku); Rb, Cs, Fr - těžší než voda. S amoniakem vytvářejí tmavě modré roztoky, s kyslíkem oxidy a peroxidy, s vodíkem a dusíkem reagují po zahřátí.
IIA.Skupina - Kovy alkalických zemin - mají 2 valenční elektrony v orbitalu s+ 2p. Stejně jako skupina 1 v přírodě tvoří sloučeniny, ale na rozdíl od první skupiny nikoli iontového charakteru. Z hlediska vlastností jsou výjimkou Beryllium a Hořčík, které se vlastnostmi více podobají alkalickým kovů. V této skupině jsou kovy relativně lehké, horší vodiče elektrického proudu (nicméně vodivost stoupá s protonovým číslem. Reaktivita stoupá od Beryllia (na vzduchu stabilní) k Radiu (krom Beryllia lépe uchovávat podobně jako alkalické kovy). Hořčík reaguje za normální teploty s kyslíkem i vodou a za vyšších teplot i s jinými prvky, stejně jako další prvky této skupiny. Na vzduchu se na povrchu oxidují.
III.A - VII.A skupina - zahrnuje prvky tří podskupin – kovy, polokovy, nekovy (podle vlastností souvisejících s nárůstem protonového čísla ve skupinách).
Kovy - elektropozitivní, se snahou předávat valenční elektrony a tvořit jednoatomové kationty. Mají vysokou elektrickou a tepelnou vodivost. III.A skupina - hliník, galium, indium, thalium III.B -skupina železa (Fe, Co, Ni), skupina lehkých platinových kovů (Ru, Rh, Pd), skupina těžkých platinových kovů (Os, It, Pt) + IV.A skupina - cín, olovo, V.A skupina bismut + transurany. V přírodě ve formě oxidů, sulfidů.
Polokovy - mají střední pevnost vazby valenčních elektronů. Bor, křemík, germanium, arsen, selen, antimon, tellur, astat. Tvoří obvykle amfoterní oxidy, chovají se jako polovodiče. Jsou křehké, nejsou kujné.
Nekovy - mají vysokou pevnost vazby valenčních elektronů a vysokou elektronegativitu. Patří k nim vodík, uhlík, dusík, kyslík, fosfor, síra, selen (k nekovům patří i VII.A. a VIII.A skupina). Jsou izolanty nebo nejvýš polovodiče. Často tvoří iontovou vazbu s elektropozitivními prvky, nebo kovalentní vazbu s ostatními prvky. Tvoří kyselinotvorné oxidy.
VII.A. Skupina - Halogeny - mají 7 valenčních elektronů, 2 v orbitalu s, a 5 v orbitalu p. Patří tam fluor, chlor (plyny), brom(kapalina), jód (pevná látka). Jedná se o prvky velmi reaktivní, v přírodě pouze ve sloučeninách, v čisté formě dvouatomové. Tvoří soli, mohou být vázány v organických sloučeninách, mají iontové vazby s elektropozitivními kovy. Fluor má oxidační číslo -I, ostatní prvky ho mohou měnit od –I, +I, +III, +V, +VII (chlór, bróm +IV, chlor i +VI). Oxidy halogenidů jsou kyselinotvorné.
VIII. A skupina - Vzácné plyny - mají plně obsazený valenční orbital (s2p6), což vede k tomu, že jsou velmi málo reaktivní (velmi těžko ztrácejí a nemohou přijímat valenční elektron). Jedná se o bezbarvé plyny ve formě jednoatomových částic, s nízkou teplotou tání a varu. Výjimečné helium - v tekuté podobě supervodič.
III.B-VII.B - Přechodné kovy (3.-12. sloupec tabulky)- což je skupina kam patří prvky d-bloku, včetně zinku, kadmia, rtuti, kopernicia. V každé z period, ve kterých se vyskytují, vykazují tyto prvky postupné přidávání elektronů do atomových orbitalů d. Přechodné prvky tak představují přechod mezi skupinou „2“ kovů alkalických zemin (vápníkem, stronciem, bariem) a skupinou „13“ (galium, indium, thalium). Typickými vlastnostmi je pevnost v tahu, vysoká hustota, teplota tání a varu (dané sdílenými d elektrony zvyšujícími pevnost krystalické mřížky).
Beketovova řada kovů
Uspořádání kovů podle elektrodového potenciálu, charakterizuje redoxní vlastnosti kovů a rozdělení na tzv. kovy ušlechtilé a kovy neušlechtilé. Toto rozdělení odráží reakce kovů s kyselinami a mezi sebou navzájem. Kov stojící před vodíkem, tj. se záporným elektrodovým potenciálem, je schopen redukovat vodík a sám sebe zoxidovat. Kovy s výrazně záporným potenciálem, jsou schopny zredukovat vodík i z vody. Kov stojící za vodíkem, tj. s kladným elektrodovým potenciálem je schopný oxidovat vodík a sám sebe redukovat. Kov s nižším elektrodovým potenciálem dokáže redukovat kov s vyšším elektrodovým potenciálem a sám se při tom oxidovat.
Lithium (-3,04), Cesium (-3,03), Rubidium (-2,98), Draslík (-2,93), Barium (-2,91), Stroncium (-2,89), Vápník (-2,87), Sodík (-2,71), Hořčík (-2,37), Beryllium (-1,85), Hliník (-1,66), Titan (-1,63), Mangan (-1,19), Zinek (-0,76), Chróm (-0,74), železo (-0,44), Kadmium (-0,40), Indium (-0,34), Thalium (-0,34), Kobalt (-0,28), Nikl (-0,25), Cín (-0,13), Olovo (-0,13), Vodík (0), Měď (+0,16), Bismut (+0,2), Osmium (+0,25), Ruthenium (+0,3), Stříbro (+0,80), Rtuť (+0,80), Platina (+1,19), Zlato (+1,52).
Uspořádání valenčních elektronů atomů v jednotlivých periodách a skupinách tabulky
Periody:
I.perioda - atom má elektrony v orbitalu s (2 prvky)
II. a III. perioda – má elektrony v orbitalech 2s+2p a 3s+3p (8+8 prvků)
IV. perioda - má elektrony v orbitalech 4s+3d (přechodné prvky) a 4s+3d+4p u základních
V. perioda - u přechodných prvků se nejprve zaplňuje 4d, pak 5d
Blok s - valenční elektrony jsou v orbitalu s. Jde o skupinu 1 a 2 - alkalické kovy a kovy alkalických zemin + H, He. Tyto elektrony velmi snadno odevzdávají a tvoří kationty (velmi reaktivní, krom He).
Blok p - valenční elektrony jsou v orbitalu p. Jde o posledních 6 skupin, mimo Helia.
Blok d - valenční elektrony v orbitalu d. Jde o tzv. přechodné (tranzitivní) kovy skupin 13-11. Mají vysokou pevnost v tahu, hustotu, teplotu tání a varu (dané velkým počtem sdílených elektronů). Mají variabilní hodnoty oxidačního čísla, jsou často součástí katalyzátorů, tvoří komplexní sloučeniny, jsou paramagnetické, jejich sloučeniny často barevné.
Blok f - lanthanoidy (prvky s atomovým číslem 57-71) a aktinoidy (prvky s atomovým číslem 89-103). Oxidační číslo většinou mezi +2 až +6. Velmi reaktivní, v reakci s vodou uvolňují vodík, typickou sloučeninou jsou iontové soli.
Látkové množství
Mol - množství látky s počtem částic (atomů) stejným, jako je ve 12g čistého nuklidu 12C (což je Avogadrova konstanta, 6,022 * 1023/mol).
Molární hmotnost pak udává hmotnost látky s počtem částic 1 mol. Tato charakteristika mimo jiné umožńuje počítat hmotnosti jednotlivých reaktantů a produktů v chemických reakcích.
Hmotnost jednotlivých atomů se pohybuje řádově v jednotkách 10- 26, 27. Proto se používá takzvaná atomová hmotnostní konstanta, jejíž hmotnost je definována jako jedna dvanáctina hmotnosti uhlíku 12C. Atomová hmotnostní jednotka 1u- se pak rovná atomové hmotnostní konstantě.
Relativní atomová hmotnost- je podíl hmotnosti atomu a atomové hmotnostní konstanty. Obdobně je charakterizována relativní molekulová hmotnost.
2.5 Chemická vazba
Jedná se o sdílení elektronů mezi dvěma atomy - o silovou interakci. Předpokladem vazby je dostatečné přiblížení reagujících atomů a vhodná kombinace volných elektronů. Podstatou je sdílení elektronového páru dvěma atomy (popis této interakce pomocí vlnových funkcí), s tím, že je zde snaha o doplnění elektronů do volných orbitalů, což ve výsledku vede k jejich stabilizaci.
Vazba může být charakterizována svojí délkou (vzdálenost jader obou atomů), přičemž násobné vazby jsou kratší, než vazba jednoduchá, a vazby s elektrony z orbitalu s jsou také kratší.
Další charakteristikou je energie vazby - disociační energie, kterou je potřeba vynaložit na přerušení vazby.
Vazba rovněž může mít různý úhel ve vztahu k hlavní rovině molekuly: lineární, lomená… Úhel vazby ovlivňuje některé charakteristiky molekuly, jako např. rozptyl elektromagnetického, nebo Rentgenova záření. Rovněž u jednoduchých vazeb je možná otáčivost molekul okolo této vazby, zatímco u vícenásobných nikoli.
Dělení:
1. Podle násobnosti vazby (podle množství sdílených elektronů (volných orbitalů))
Jednoduchá vazba – σ vazba – patří mezi kovalentní vazby. Největší elektronová hustota je na spojnici jader obou atomů.
Násobné vazby – dvojná vazba je tvořená jednou vazbou σ (sigma) a jednou vazbou π (pí). Trojná vazba je tvořena jednou vazbou σ a dvěma vazbami π. Největší elektronová hustota je mimo spojnici jader.
2. Podle typu sdílení
Kovalentní vazba - je založena na sdílení elektronových párů a orbitalů, ve kterých se tyto sdílené páry elektronů nacházejí.
Koordinačně-kovaletní vazba – vazba příjemce a dárce elektronu; jeden atom poskytuje volný elektronový pár a druhý atom prázdný orbital (typické pro prvky s elektrony v d orbitalu). Molekula pak tvoří dipól s kladným a záporným koncem.
3. Podle polarity (elektronegativity reagujících atomů)
Nepolární vazba - mezi atomy s velmi malým rozdílem elektronegativit (nebo stejné atomy - např. u halogenidů). Elektronová hustota je rovnoměrně rozdělena mezi oba atomy.
Polární vazba - Rozdíl elektronegativit atomů je v intervalu 0,4-1,7. Hustota elektronů je nerovnoměrná mezi oběma reagujícími atomy, vznikne dipól - rozdíl náboje různých částí molekuly.
Iontová vazba – Výrazný rozdíl elektronegativit reagujících atomů, dochází k přesunu sdílených elektronů k atomu s vyšší elektronegativitou, vznikají iontové sloučeniny.
Kovová vazba - charakteristická pro kovy. Je odpovědná za kujnost a tažnost kovů. Valenční elektrony vytvářejí tzv. elektronový mrak, který je sdílen všemi atomy v krystalové mřížce kovu.
Slabé vazebné interakce - patří mezi molekulové interakce, jedná se o přitažlivost na základě opačného náboje a patří sem Vodíkové můstky a Van der Waalsovy síly. Jsou desetinásobně slabší než výše uvedené vazby, vznikají v nepolárních molekulách. Jejich podstatou je přitažlivost daná polaritou molekul a možné přitažlivé síly mezi dvěma různými „póly“ molekul (Coulombova síla, vodíková vazba), přitažlivost daná tím, že kmitáním molekul může přechodně vznikat dipól (disperzní síla),přítomností trvale polarizovaných molekul ovlivňujících molekuly okolní (indukční síla).
2.6 Chemická reakce
Interakce (spojování, přeskupování, oddělování) částic (iontů, atomů, molekul), vedoucí ke změně vazeb poutajících atomy jednotlivých prvků - k jejich zániku a novému vzniku a tím ke změně chemického složení původní látky (reaktantu, substrátu) za tvorby látky s jinou chemickou strukturou (produktu). V průběhu procesu dochází ke změnám chemických vazeb. Látky mají tendenci uchovávat si tu strukturu, která je pro ně energeticky výhodná - má relativně nejmenší energii a v rámci chemické reakce dochází k takové změně stávajících látek, která ve výsledku vede ke vzniku stabilnějších struktur.
Při chemické reakci nedochází ke vzniku, zániku atomů, ani se atom jednoho prvku nemůže měnit na atom jiného prvku.
Látky, které spolu reagují, nazýváme reaktanty, látky vznikající při chemických reakcích produkty. Průběh chemické reakce je možné popsat chemickou rovnicí, která zapisuje množství reagujících atomů a molekul ve vztahu k molekulám vznikajících látek. Reaktanty zapisujeme na levou, produkty na pravou stranu rovnice. Vzhledem k existenci Zákona zachování hmoty a tomu, že ve většině případů nedochází k jaderným přeměnám a změně prvků jednoho v jiný, musí odpovídat počet atomů určitého prvku na jedné straně rovnice, počtu atomů na straně druhé a současně hmotnost reaktantů hmotnosti produktů. Úpravu a vyčíslení chemických rovnic provádíme pomocí tzv. stechiometrických koeficientů zapisovaných před chemický vzorec. Možným doplňkem je iontový zápis (udávající reagující ionty a možnosti příjemců a donorů elektronů vstupujících do chemické reakce), stavový zápis doplňující skupenství reagujících látek.
Obecně při reakci prvků X a Y a tvorbě sloučeniny XY :
Xa + w.Yb ---> v.XcYd
v, w - stechiometrická čísla; a, b, c, d- počet konkrétních atomů;(x,y)v reaktantech a produktech.
Musí platit, že pro X a=v.c, pro Y w.b =v.d
Pro redoxní reakce současně platí podmínka rovnosti počtu vyměňovaných elektronů, Pro iontové rovnice podmínka celkové elektroneutrality (součet nábojů reaktantů rovná se součtu nábojů produktů). Mezi chemické reakce, které probíhají beze změny oxidačního čísla patří zejména acidobazické reakce, koordinační reakce, tepelné rozklady a srážecí reakce. Při redoxních reakcích dochází zároveň k přijímání elektronu (redukce) jedním atomem a uvolňování elektronu (oxidace) druhým atomem, přičemž celkový součet vyměňovaných elektronů by měl být vyrovnaný.
Rychlost chemických reakcí je ovlivněna několika základními faktory:
Koncentrací reagujících látek (ovlivňuje pravděpodobnost přiblížení reagujících iontů, nebo atomů), Skupenství reaktantů (kontakt jen na rozhraní rozdílných fází, optimální kontakt v případě kapalných reaktantů).
Teplota (zejména pro endotermické reakce, ale i v ostatních případech teplota zvyšuje rychlost pohybu částic v látce).
Katalyzátor - látka, která zvyšuje rychlost chemické reakce (nebo ji umožňuje), ačkoli se v průběhu reakce nespotřebovává a sama se chemicky nemění. Podstata spočívá v tvorbě nestabilních meziproduktů (reaktant s katalyzátorem) - díky katalyzátoru je aktivační energie dílčích reakcí nižší, než aktivační energie reakce stejných reaktantů, která by probíhala bez katalyzátoru. Katalyzátorem mohou být ionty, kyseliny, zásady, produkt reakce (autokatalýza). Selektivními specifickými katalyzátory jsou enzymy) dáno prostorovou strukturou enzymu a substrátu).
Průběh chemických reakcí je dále ovlivněn chemickou rovnováhou, což je dynamický stav, při jehož dosažení se dále nemění koncentrace reaktantů ani produktů (vyrovnaný průběh přímé a zpětné reakce). K posunu této rovnováhy může dojít změnou teploty, nebo přidáním reaktantů, nebo odebráním produktů.
Reakční rychlost je dána časovým úbytkem látkového množství kteréhokoli reaktantu, nebo přírůstkem látkového množství kteréhokoli produktu.
Rozdělení typů reakcí:
Podle skupenství
Homogenní - všechny reaktanty a produkty probíhají ve stejné fázi hmoty (pevná, kapalná, plynná látka)
Heterogenní - reaktanty a produkty jsou různého skupenství.
Podle reagujících částic
Molekulové - reaktanty i produkty jsou v průběhu celé reakce elektroneutrálními molekulami.
Radikálové - reagujícími částicemi (nebo meziprodukty) jsou nestabilní částice s nepárovými elektrony.
Iontové - reakce probíhající v kapalném prostředí (voda, polární rozpouštědlo), ve kterém reagující látky disociují na ionty.
Podle směru reakce
Přímé - základní typ reakce kdy se z určitých reaktantů vytváří jen jeden typ produktů.
Zpětné - reakce probíhá stejným mechanismem, pouze v opačném směru (produkt se rozpadá na původní reaktanty).
Větvené - Z jednoho typu reaktantů může reakce probíhat několika způsoby a vytvářet různé produkty.
Řetězové - Produkt reakce dále reaguje stejným způsobem (polymerace).
Podle rovnováhy reakce
Jednosměrné - úroveň zpětných reakcí (rozpad produktu zpět na původní reaktanty) je minimální.
Rovnovážné - reakce probíhá až do vyrovnané hodnoty průběhu původní a zpětné reakce.
Podle změn reaktantů a produktů
Syntéza - slučování, ze dvou nebo více prvků nebo sloučenin vznikne jeden produkt (sloučenina složitější struktury, než byly reaktanty).
Analýza - rozklad, kdy se naopak složitější látka rozkládá na několik látek (molekul) jednodušších.
Substituce - nahrazování (vytěsňování)- nahrazení funkční skupiny jiným atomem nebo molekulou.
Konverze - podvojná záměna- vzájemná výměna funkčních skupin v reagujících sloučeninách.
Hoření - intenzivní oxidace za současného uvolnění energie ve formě tepla.
Podle reakčního mechanismu (organická chemie)
Adice - navázání reaktantu na násobnou vazbu substrátu (hydratace, halogenace)- čímž tato násobná vazba zaniká.
Eliminace - Odštěpení jednoduché (anorganické) sloučeniny za následného vzniku násobné vazby (dehydrogenace, dehydratace).
Substituce - nahrazení funkční skupiny jiným atomem nebo molekulou.
Konverze (přesmyk) - dochází ke změně prostorové struktury sloučeniny, nikoli ke změně chemického složení.
Komplexotvorné reakce - na centrální atom nebo molekulu se váží další funkční skupiny, vznikají tzv. koordinační sloučeniny.
Podle přenášených částic
Oxidačně redukční reakce - přenášenou částicí je elektron, v rámci reakce probíhá současně oxidace jedné látky (odevzdání elektronů, oxidační číslo se zvyšuje) a redukce druhé látky (příjem elektronu, oxidační číslo se snižuje). Redoxní reakce je možné rozdělit do dvou stupňů dané reakce, kdy jeden stupeň představuje redukci a druhý oxidaci. Oxidační činidlo je látka, která je schopna přijímat elektrony (při tom se redukuje) a současně napomáhá oxidaci druhé látky (které ty elektrony naopak uvolňuje). Typická oxidační činidla jsou např. kyslík, peroxid vodíku, chlór a jeho sloučeniny, koncentrované kyseliny, manganistan draselný. Redukční činidlo je látka, která uvolňuje v reakci elektrony a sama se při tom oxiduje, přičemž redoxní (redukčně oxidační) chování jedné látky záleží na redoxních vlastnostech dalších látek ve směsi. Typické redukční činidlo jsou např. sulfidy, chloridy, bromidy, kovové prvky, vodík…
Acidobazické reakce (protolytické) - přenášeným typem iontu je vodíkový kationt, látka která ho uvolňuje se nazývá kyselina, látka která tento proton přijímá - zásada (neutralizace jako reakce kyseliny s hydroxidem).
Reakce komplexotvorné - přenos celých skupin atomů.
Podle termodynamiky
Exotermní reakce - během reakce je uvolňována energie ve formě tepla, energie reaktantů je větší než energie produktů (dýchání, hoření, neutralizace).
Endotermní reakce - pro průběh reakce je nutné dodat energii (spotřebovává se), energie produktů je vyšší než energie reaktantů (fotosyntéza) .
Průběh základních chemických reakcí:
Reakce dvou prvků (výsledkem např.: soli - sulfidy, bromidy, chloridy…
Reakce kovu a kyseliny (při průběhu reakce záleží na charakteru kovu, síle kyseliny (redoxní vlastnosti), teplotě, koncentraci kyseliny. Většina kovů reaguje s kyslíkatou kyselinou i kyselinami bez oxidačních vlastností za tvorby soli a vytěsnění vodíku. Ušlechtilé kovy reagují jen s kyslíkatými kyselinami za tvorby soli nebo oxidu, kde má kovový prvek nižší oxidační číslo než výchozí kyselina. Zvláštním případem je kyselina dusičná, která je při nižších koncentracích a v reakci s neušlechtilým kovem silnější redukční činidlo, než při vysokých koncentracích.
Reakce prvku se solemi Mají charakter substitučních redoxních reakcí. Záleží na charakteru prvku (kov, nekov), jeho oxidačním čísle. Neušlechtilé kovy se v reakci se solemi ušlechtilých kovů (Cu, Ag, Au, Hg, Ru, Rh, Pd, Re, Os, Ir, Pt) oxidují. Nekovy s nižším protonovým číslem jsou redukovány nekovem s vyšším protonovým číslem (halogenidy, sulfidy..)
Reakce oxidů s kyselinamiČasté jsou reakce oxidů kovů s kyselinami, za tvorby soli kovu + uvolnění vody)
Reakce hydroxidů s kyselinamiNeutralizační - produktem jsou soli a uvolněná voda.
Reakce oxidů s hydroxidy Reagují kyselinotvorné hydroxidy (nekovů), nebo oxidy amfoterních kovů (cr, Sn, fe, Zn). V roztoku vznikají hydrokomplexy, v taveninách soli.
Reakce oxidů navzájem Reaktanty jsou oxidy kovů a nekovů, produktem soli.
Reakce oxidů se solemi Oxid silnější kyseliny zpravidla vytěsní z roztoku oxid slabší nebo těkavější kyseliny.
Reakce hydroxidů se solemi Podvojná záměna podle oxidačního čísla, produktem může být i ve vodě nerozpustná sůl- sraženina.
Reakce kyselin se solemiPodvojná záměna podle oxidačního čísla, s možností vytěsnění kyseliny (pokud je velmi slabá).
Reakce dvou solí navzájemPodvojná záměna podle oxidačního čísla, ke které dojde v případě, že má jeden z produktů nižší rozpustnost (vznik sraženiny).
Energetika chemických reakcí
Energetickou bilancí chemických dějů se zabývá chemická termodynamika. Studuje soustavy jako celek, z energetického hlediska, bez ohledu na strukturu částic. Pomáhá určit, zda je daný děj z energetického hlediska uskutečnitelný. Popisuje stavové funkce- vnitřní energii, entalpii, reakční teplo. Reakce za podmínky konstantní teploty jsou - izotermické, za konstantního tlaku - izobarické, za konstantního objemu - izochorické a v tepelně izolované soustavě – adiabatické. Energetika chemických reakcí je založená na třech základních principech:
První termodynamický zákon o vnitřní energii říká, že teplo a práce dodané uzavřené soustavě, zvyšují její vnitřní energii ΔU). Obdobně platí o entalpii (což je charakteristika změny stavu soustavy při stálém tlaku - otevřené soustavy). Teplo dodávané soustavě při konstantním tlaku se spotřebuje na zvýšení její entalpie (H). Z toho plyne že koná li soustava práci, dochází buďto ke snížení vnitřní energie soustavy, nebo k odběru tepla z okolí.
Reakční teplo, je teplo přijaté soustavou při uskutečnění reakce za podmínky stejných teplot reaktantů (izochorická, nebo izobarická reakce). Na druhou stranu platí, že reakční teplo odpovídá rozdílu energie reaktantů a produktů. Pokud reakce probíhá v jednotkovém – molárním rozsahu (gramy reagující látky odpovídají 1 molu), mluvíme o molárním teple reakce. Reakce, kdy není rozdíl mezi energií reaktantů a produktů (teplo se během nich ani neuvolňuje, ani není potřeba energii v průběhu reakce dodávat) jsou méně častým jevem a většinou jsou nevratné.
První termochemický zákon pak říká, že reakční teplo přímé a zpětné reakce, pokud probíhá za stejných podmínek, je stejné (až na opačné znaménko).
Slučovací teplo, je reakční teplo reakce, při níž z reaktantů vznikne 1 mol sloučeniny- produktu (za standardních podmínek).
Spalné teplo je teplo, kdy 1 mol látky zoxiduje na konečné- nejstálejší - oxidační produkty.
Druhý termodynamický zákon zavádí Entropii (S) charakterizující uspořádanost uzavřené (adiabatické) soustavy a množství energie spotřebované na uspořádaný stav. Uspořádanost soustavy se u vratných reakcí nemění, u nevratných klesá, přičemž je vždy vyšší pravděpodobnost a vyšší stabilita nejméně uspořádaného stavu soustavy, z několika možných. Samovolné děje lze charakterizovat zvětšením entropie (vzrůstem neuspořádanosti) vzhledem ke stavu výchozímu. Entropie tedy udává směr nevratných reakcí u adiabatických soustav.
Směr nevratných procesů v izobarických a izochorických je adekvátně charakterizován Gibbsovou (G) (izotermicko–izobarický děj) a Helmholtzovou (A) (izotermicko-izochorický děj) energií. Úbytek této energie soustavy při ději se rovná práci, kterou by soustava při vratném ději předala okolí. Samovolný děj je pak provázen poklesem Gibbsovy (nebo Helmholtzovy ) energie a rovnováha soustavy je určena minimem této energie.
2.7 Anorganické látky
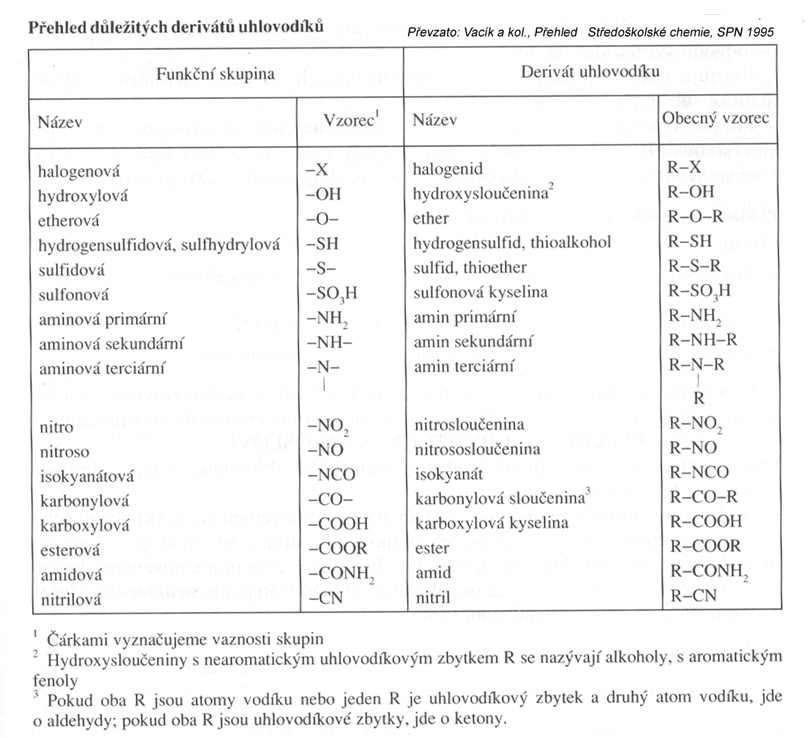
Všechny chemické prvky, anorganické sloučeniny a jejich směsi, mimo sloučenin obsahujících uhlík (výjimkou oxid uhličitý, kyselina uhličitá a její soli, sirouhlík (CS) a kyselina kyanovodíková (HCN), které také patří k anorganickým látkám). Anorganické sloučeniny jsou látky skládající se ze dvou a více prvků spojených chemickou vazbou.
Anorganických látek a sloučenin existují stovky tisíc. Některé z nich byly připraveny uměle, ale značná část z nich se vyskytuje běžně v přírodě jako součásti vodního prostředí (soli, ionty), v půdním prostředí (minerály, soli, hydroxidy, kyseliny), v atmosféře (plyny, oxidy různých prvků)…
Názvosloví anorganických sloučenin
Chemické vzorce anorganických látek se skládají ze značek prvků, indexů, charakterizujících počet sloučených atomů a zápisu počtu molekul. Anorganické sloučeniny mají dvouslovný název, tvořený z podstatného jména (druh sloučeniny), odvozeného od části s větší elektronegativitou a přídavného jména označujícího část sloučeniny s menší elektronegativitou. V názvu se dodržuje pořadí podstatné jméno, přídavné jméno- ve vzorci se pořadí značek prvků píše opačně (chlorid sodný, NaCl).
Oxidační číslo
Oxidační číslo atomu prvku ve sloučenině (účastnícího se iontové polární vazby) ukazuje součet elektrických nábojů atomu- nepřímo udává možný počet přijatých nebo odevzdaných elektronů. Pokud elektrony přijímá, označuje se jako aniont, pokud odevzdává, pak jako kationt. V základním atomárním stavu má prvek oxidační číslo nula. Ve sloučeninách může mít daný prvek číslo různé, podle stupně oxidace, nebo redukce. Oxidační číslo se značí římskou číslicí s kladným nebo záporným znaménkem a píše vpravo nahoře u symbolu prvku.
Dále platí, že oxidační číslo volných atomů i molekul (celkový součet oxidačních čísel jednotlivých prvků v molekule) je roven nule. Součet oxidačních čísel prvků v iontu, se rovná náboji iontu. Elementární náboj je nejmenší možný náboj a má hodnotu 1,602*10-19 coulombu. Elektron = -1, tedy jeden záporný elementární náboj. Proton = +1, tedy jeden kladný elementární náboj. Volný elektroneutrální atom, nebo atom v molekule prvku (HO2, Cl2, krystal kovu) má oxidační číslo 0. Oxidační číslo jednojaderného iontu se rovná jeho náboji (Cl- = -1 atd.). Ve vzorcích víceatomových částic se určí oxidační číslo atomů jednotlivých prvků tak, že se „přidělí“ vazebné elektrony elektronegativnějšímu atomu. Příklad: Oxidační číslo vodíku je v běžných sloučeninách +1 pouze hydridy -1), kyslíku -2 (v peroxidech -1), oxidační číslo síry v H2S je -2, v SO2 je +4, H2SO4 je to +6, fluor má oxidační číslo -1, alkalické kovy (Li, Na, K, Rb, Cs, Fr) +1, kovy alkalických zemin (Ca, Sr, Ba, Ra) +2, halogenidy -1 (pokud se nejedná o vazbu na jiný halogenid, kyslík, nebo dusík).
Podle oxidačního čísla je tvořeno názvosloví anorganických látek
+I - ný, +II – natý, +III –itý, +IV –ičitý, +V - ičný, -ečný, +VI – ový, +VII - istý, +VII – ičelý
Záporné oxidační číslo se vyjadřuje koncovkou –id, připojené ke kmeni latinského názvu prvku. (chlorid (Cl-1), oxid (O-2), nitrid (N-3), karbid (C-4).
Dále se pro vyjádření struktury sloučenin používají předpony charakterizující počet atomových částic ve sloučenině: di, tri-, tetra-, penta-, hexa-, hepta- okta- , nona-, deka-,… Počet složitějších víceatomových částic se vyjadřuje násobnou číslovkovou předponou: bis-, tris-,….
Fyzikální vlastnosti anorganických látek
Teplota tání, teplota varu, hustota, elekrická vodivost...Elektrická vodivost souvisí s kovovým charakterem prvků, nekovy jsou nevodivé.Sloučeniny s iontovou strukturou mohou být vodivé v kapalné formě (roztok, tavenina). jsou uvedeny v chemikých tabulkách. Co se týká teploty tání a varu, dá se obecně říci, že látky s jednodušší strukturou (jedno-dvouatomové, s kovalentními vazbami) mají nízké teploty tání a varu.Látky se složitou strukturou tvořenou mnoha různými atomy a s iontovou vazbou, nebo jsou kovového charakteru mají tyto teploty vysoké. Do určité míry je možné odhadnout teplotu tání a varu prvku z umístění v Periodické tabulce: s1 prvky začínají u nízkého protonového čísla s nízkou teplotou tání, která roste s atomovou hmotností a opět klesá k nejmenším hodnotám u vzácných plynů. Nejvyšší teploty tání z A. period mají uhlík a křemík, z B. period skupina chromu a pak p2 a p3 prvky. Ve skupinách teploty tání u s1 a s2 prvků s atomovou hmotností klesají, u ostatních stoupají (mimo IIB.skupiny).
Elektrická vodivost souvisí s kovovým charakterem prvků, nekovy jsou nevodivé.Sloučeniny s iontovou strukturou mohou být vodivé v kapalné formě (roztok, tavenina).
Rozpustnost souvisí s iontovou strukturou- látky disocijující na ionty jsou rozpustné ve vodě a nerozpustné v nepolárních rozpouštědlech. Látky s kovalentními vazbami jsou většinou ve vodě nerozpustné, nebo s ní reagují.
Barevnost látek souvisí u atomů s (pohlcováním různých vlnových délek světla) nepárovými elektrony ve valenčním orbitalu (modrý kapalný kyslík, hnědý oxid dusíku), u kovů také s částečně obsazenými d nebo f orbitaly (chrom , mangan).
Důležité skupiny anorganických látek
Voda
Voda je nejrozšířenější a nejvýznamnější sloučenina vodíku a kyslíku, vyskytuje se ve třech skupenstvích - pevná, kapalná, plynná (s teplotou tání 0 °C a teplotou varu 100 °C). Při přechodu do pevné fáze zvětšuje objem o 10%. A tzv. anomálie vody způsobuje, že maximální hustotu má při 4 °C.
Molekuly vody jsou lomené, silně polární kovalentní vazby O-H. V kapalné vodě se molekuly asociují prostřednictvím vodíkových vazeb do tzv. clusterů. Může tvořit tzv. hydráty, většinou navázáním molekul vody do krystalové mřížky soli (hygroskopické látky pohlcují vodu i ze vzduchu). Je to sloučenina poměrně hodně stálá, rozkládá se až za velmi vysokých teplot. Má velmi dobrou tepelnou vodivost, velké měrné a výparné teplo, velké povrchové napětí.
Charakteristická z chemického hlediska tím, že funguje jako polární rozpouštědlo, s čímž těsně souvisí to, že může disociovat na ionty- H3O+ a OH-). Ve vodě snadno probíhá mnoho chemických reakcí. Voda sama výrazně reaguje s alkalickými kovy a kovy alkalických zemin, přičemž vzniká vodík a příslušný hydroxid (známá reakce sodíku vhozeného do vody).
Kyseliny - kyselé látky
Kyselina je látka, která má v rámci chemické reakce volný elektron a je jeho donorem (Lewisova teorie). Původní teorie- podle Bröensteda je to látka přijímající v reakci kation (proton), podle Arrhenia látka ve vodném prostředí odštěpující vodíkový proton.
Zásaditost i kyselost se měří na stupnici pH, která určuje koncentraci vodíkových kationtů v roztoku. Zásaditá je každá látka, která má pH menší než 7 (rozsah 0-7).
Existují dva základní způsoby rozdělení kyselin:
Podle chemického složení na kyslíkaté a bezkyslíkaté
a organické a anorganické.
Podle kyselosti na slabé, silné středně silné. Toto rozdělení je závislé na tzv. disociační konstantě, která udává množství disociovaných molekul kyseliny ve vodném roztoku, po ustálení disociační rovnováhy. Obecně platí, že vyšší disociační konstantě odpovídá větší množství disociovaných molekul, tedy vyšší síla kyselin a zásad. Hodnoty disociačních konstant kyselin a zásad jsou závislé na dané konkrétní látce a lze je najít v matematicko- fyzikálních tabulkách.
- Silné kyseliny: Kyselina sírová, kyselina chlorovodíková (kyselina solná, významná funkce při trávení), kyselina chloristá,
- Středně silné kyseliny: HF (leptá sklo)...
- Slabé kyseliny: např. organické - kyselina citrónová...
Oxidy
Dvouprvkové sloučeniny kyslíku s jiným prvkem, přičemž kyslík je elektronegativnějším prvkem a má oxidační číslo –II.
Iontové oxidy mají iontovou vazbu (sloučeniny lanthanoidů, kovů s valenčními elektrony v s orbitalu) vysoké teploty tání a malou těkavost.
Kovalentní oxidy mají kovalentní vazbu a druhým prvkem je nekov, (C, N, P, S), jsou těkavé a kapalné nebo plynné.Pokud je druhým prvkem prvek ze středí části periodické tabulky (Ti, Hg, Al, Si), mohou mít oxidy polymerní strukturu a jsou málo těkavé.
Podle reakce dělíme oxidy na kyselino- a zásadotvorné a amfoterní.
- Kyselinotvorné oxidy se slučují s vodou na kyslíkaté kyseliny a ve vodě nerozpustné tvoří se zásadami soli. Druhým prvkem oxidu je nekov, nebo oxid kovu s oxidačním číslem větším než V.
- Zásadotvorné oxidy se slučují s vodou na hydroxidy. Druhým prvkem je kov s oxidačním číslem menším než IV (Ca, Mg) , nebo se jedná o oxidy s iontovou vazbou mezi prvky.
- Amfoterní oxidy (oxidy kovů s menšími oxidačními čísly a kovalentní vazbou). S kyselinami a hydroxidy substituční reakce.
Peroxidy jsou dvouprvkové sloučeniny se dvěma atomy kyslíku spojenými kovalentní vazbou, přičemž jejich oxidační číslo je –I. Peroxid vodíku jako nejběžnější příklad je velmi nestálá, slabě kyselá sloučenina s převážně oxidačními účinky (mimo velmi silných oxidačních činidel, na která působí redukčně).
Zásady- zásadité látky
Zásada je látka, která má v rámci chemické reakce volný elektron a je jeho donorem (Lewisova teorie). Původní teorie - podle Bröensteda je to látka přijímající v reakci kation (proton), podle Arrhenia látka ve vodném prostředí odštěpující 0HO- ion.
Zásaditost i kyselost se měří na stupnici pH, která určuje koncentraci vodíkových kationtů v roztoku, nebo na stupnici pOH, která určuje koncentraci hydroxidových aniontů v roztoku. Zásaditá je každá látka, která má pH větší než 7 nebo pOH menší než 7.
Soli
Soli jsou chemické sloučeniny s iontovou vazbou, spojující kationt kovu a aniont (jednotlivé složky mohou být jedno i víceatomové, organické i anorganické). Často to jsou pevné krystalické látky v roztoku vedoucí el. proud.
Mohou vznikat neutralizací kyseliny zásadou, reakcí hydroxidu s kyselinotvorným oxidem, reakcí kovu s nekovem (Na Cl).Se solemi, kyselinami a hydroxidy mohou reagovat v rámci substituce, nebo konverze.
Bezkyslíkaté soli jsou často sloučeniny halogenidů. Názvy jsou složeny z podstatného jména (kořen bezkyslíkaté kyseliny s koncovkou – id) a přídavného jména (koncovka dána oxidačním číslem).
U kyslíkatých solí je přídavné jméno stejné, podstatné jméno tvořeno kořenem prvku a příponou podle oxidačního čísla (I-nan, II-natan, III-tan, IV-ičitan, V-ičnan, -ečnan, VI-an, VII-istan, VIII-ičelan).
| iont | Na+ | K+ | Ag+ | NH4+ | Ca2+ | Ba2+ | Mg2+ | Cu2+ | Pb2+ | Mn2+ | Zn2+ | Fe2+ | Fe3+ | Al3+ | Cr3+ |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| OH- | R | R | - | R | R | R | N | N | N | N | N | N | N | N | N |
| Cl- | R | R | N | R | R | R | R | R | N | R | R | R | R | R | R |
| Br- | R | R | N | R | R | R | R | R | N | R | R | R | R | R | R |
| I- | R | R | N | R | R | R | R | N | N | R | R | R | R | R | R |
| S2- | R | R | N | R | R | R | R | N | N | N | N | N | N | H | H |
| NO3- | R | R | R | R | R | R | R | R | R | R | R | R | R | R | R |
| SO42- | R | R | N | R | N | N | R | R | N | R | R | R | R | R | R |
| CO32- | R | R | N | R | N | N | N | N | N | N | N | N | N | N | N |
| PO43- | R | R | N | R | N | N | N | N | N | N | N | N | N | N | N |
R – rozpustné ve vodě
H – hydrolyzuje na hydroxid
N – nerozpustné ve vodě („nerozpustnost“ kolísá v širokých mezích, vylučování sraženiny u
některých látek probíhá jen z koncentrovanějších roztoků – např. Ag2SO4, PbCl2 aj.)
Komplexní soli (cheláty)
Tvoří je několik podjednotek (s více vazebnými skupinami) vázaných na centrální atom, (součástí je atom kovu, většinou atom nebo iont přechodného kovu)), ligandy (podjednotky navázané na centrální atom) mohou být anionty i elektroneutrální molekuly vázané koordinačními vazbami, přičemž výsledná molekula je elektroneutrální. Častou podjednotkou je voda vázaná v rámci molekuly (aqua). Vznikem koordinační vazby se mění vlastnosti původních atomů nebo molekul (rozpustnost, reaktivita…)
Př.: hexakyano železitan železnatý Fe3[Fe(CN)6]2, hexafluoro hlinitan sodný Na3[AlF6]
Pokud mají cyklickou strukturu (organickou část molekuly), označují se jako cheláty (mají koordinačně kovalentní vazbu atomů)
Rostliny dokáží uvolňovat do půdy slabé organické kyseliny (např. kyselina citrónová), nebo aminokyseliny a přijímat kovy vázané v chelátových solích těchto kyselin, což téměř úplně snižuje toxicitu kovu. Přirozené komplexní sloučeniny jsou např. hemoglobin a chlorofyl. Nejčastější uměle vyrobená chelatační činidla používaná pro příjem kovových prvků z hnojiv jsou: EDTA - kyselina ethylendiamintetraoctová (vhodná k vázání Mn2+,Zn2+,Cu2+, železo (Fe2+ i Fe3+)), DTPA - kyselina diethylentriaminpentaoctová (vhodná k vazbám Fe), EDDHA - kyselina ethylenediamindihydroxyphenyloctová (vhodná k vazbám Fe), EDDHA a DTPA chelatují jen železo.
Prvky potřebné pro život organismů
Mezi prvky nezbytné pro život organismů patří prvky, které jsou součástí základních stavebních sloučenin organismů, tzv. organických látek. Dále sem patří prvky nezbytné pro průběh biochemických reakcí v živých organismech, které nemusí fungovat jen jako stavební, ale i jako substrát, donor elektronů, katalyzátor biochemické reakce...
C, O, H (N) - základní biogenní prvky, jako základní stavební kameny organických látek tvoří 95-99 % sušiny těl organismů.
Makroelementy: N, P, K, Ca, Mg, Fe, S - prvky které jsou obsaženy ve všech živých organismech řádově v %, nebo desetinách procent
Mikroelementy: Cu, Zn, Mo, Co, Mn, B, Cl, Na - prvky které jsou obsaženy ve všech živých organismech v řádově tisícinách nebo menším množství
Al, V, I, Si, Sn, Ni, Cr, F, Se - Prvky, které jsou součástí živých organismů, ale ne nutně všech.
Vodík
První člen periodické soustavy prvků s nejjednodušší konfigurací s1, přičemž je to prvek s nejmenší hmotností a poloměrem atomu. Tvoří tři izotopy: lehký (běžně se vyskytující) vodík - (protium) 11H, těžký vodík 12H (deuterium) a radioaktivní tritium 13H. Za normálních podmínek je to bezbarvý pyn. výskyt převážně ve sloučeninách, např. vázaný ve vodě. Jako čistý plyn má výbušné vlastnosti a je nestálý a reaktivní. je to typický nekov s vysokou elektronegativitou.
Může reagovat téměř se všemi prvky, přijetím elektronu od atomu s malou elektronegativitou vznikají hydridy, může se účastnit lární i nepolární kovalentní vazby. Pokud je vázán polární kovalentní vazbou s atomy o velké elektronegativitě (N, P, F), vazby je asymetrická a mohou vznikat vodíkové vazby nebo tzv. můstky.
Kyslík
Atomy jsou nestálé a reaktivní. Stabilní elektronovou konfiguraci získávají buďto přijetím dvou elektronů, nebo vytvořením dvou jednoduchých nebo dvojné kovalentní vazby, nebo vytvořením kovalentní vazby a přijetím jednoho elektronu. Elektrony má v orbitalech sigma a pí. Ve sloučeninách má oxidační číslo –II, vyjímečně jiné: -I v peroxidech, +II ve fluoridu kyslíku.
Bezbarvý plyn tvořený molekulami O2, zkapalnělý má modrou barvu. Nestabilně v čisté formě jako ozon, O3. Vytváří tři izotopy: s neutronovým číslem 16, 17, 18.
Při běžných teplotách je reakce (oxidace) exotermická a relativně pomalá (dýchání) za vyšších teplot bouřlivá (hoření). Má menší rozpustnost ve vodě. Ve formě ozonu velmi reaktivní, silné oxidační činidlo (pro živočichy nervový jed). Sloučeniny kyslíku jsou: oxidy, peroxidy, hydroxidy, kyseliny
Dusík
Patří mezi p3 prvky, V.A skupiny. Za běžné teploty je to bezbarvý plyn (teplota tání je -210, varu -195 °C), tvořící stabilní N2 molekuly spojené trojnou kovalentní vazbou- nepodporuje hoření, je málo rozpustný (používá se jako levná ochranná atmosféra při chemických reakcích a kapalný na uchování látek při velmi nízkých teplotách). Dusík má vysokou elektronegativitu - ( 3,1) a je většinou čtyřvazný, ale oxidační číslo se pohybuje v rozmezí –III až +V.
V přírodě je v dusičnanech - např. chilský ledek (NaNO3), ve formě amoniaku, oxidů, organických sloučenin. Zahřátím s Si, B, Al a s2 prvky tvoří nitridy.
Amoniak NH3 (čpavek) je bezbarvý páchnoucí plyn, vznikající v přírodě rozkladem dusíkatých organických látek. Tvoří polární molekuly, s volným elektronovým párem náležejícím dusíku, čemuž odpovídá zásaditá povaha amoniaku. Je dobře rozpustný ve vodě (disociuje na amonný kationt a OH aniont), s kyselinami vytváří amonné soli. Může se účastnit i komplexotvorných reakcí jako donor elektronového páru. Používá se jako kapalné hnojivo ve formě síranu nebo dusičnanu amonného, uhličitan amonný je spolu s hydrogenuhličitanem sodným v kypřícím prášku do pečiva.
V kyslíkatých sloučeninách - oxidech - má dusík oxidační číslo +I až +V. Oxidy dusíku vznikají při rozkladu organické hmoty v půdě, při spalování biomasy, fosilních paliv. Za přítomnosti vody (v atmosféře) tvoří kyselinu dusičnou.
Kyselina dusičná je silné oxidační činidlo, (koncentrovaná - 68%) oxiduje všechny kovy mimo zlata a platiny. Je součástí Lučavky královské (směs kyseliny dusičné a chlorovodíkové v poměru 1:3), která rozpouští i zlato. Používá se také při výrobě hnojiv, výbušnin, hutnictví, chemickém průmyslu.
Fosfor
Patří mezi p3 prvky, V.A skupiny. Je to nekov, s teplotou tání 44 a teplotou varu 280 °C. Oxidační číslo v rozpětí –III, +III, +V. Čistý se vyskytuje v různých formách krystalové mřížky: P4 – bílý fosfor (trojboký hranol), je nejreaktivnější, na vzduchu hoří, je jedovatý. Pn – červený fosfor (polymerní amorfní struktura), stálý a nejedovatý. Pn – černý fosfor, kov s vrstevnatou strukturou, stabilní. V přírodě se fosfor vyskytuje ve sloučeninách odvozených od kyseliny fosforečné , např. fosforitech a apatitech - Ca5X(PO4)3 kde x = F, Cl, nebo OH, v živých organismech ve formě fosfátového zbytku vázaného silně energetickou vazbou na organickou molekulu (ATP, DNA, fosfolipidy).
Spalováním fosforu vzniká oxid fosforečný P4O10, který s vodou tvoří kyselinu trihydrogen fosforečnou. H3PO4 je středně silná kyselina, stálá, nemá oxidační vlastnosti, většinu kovů nerozpouští. Zahřívání vede ke tvorbě polymeru spojováním fosforečnanových skupin až na polyfosforečné kyseliny. Od kyseliny fosforečné se odvozují tři řady solí: fosforečnany X3PO4, hydrogenfosforečnany X2HPO4 a dihydrogenfosforečnany XH2PO4.Ve vodě rozpustné jsou jen fosforečnany a hydrogenfosforečnany s1 prvků a dihydrogenfosforečnany s1 a s2 prvků. Pomocí silných kyselin lze ostatní také převést na soli ve vodě rozpustné.
Draslík
Patří mezi prvky IA. skupiny, s1prvky, což jsou typické (alkalické) kovy, vysoce reaktivní a silná redukční činidla (sama se oxidují na kationty). Reaguje přímo se vzdušným kyslíkem (nutno uchovávat v petroleji), bouřlivě s vodou, se sírou, vodíkem…
V přírodě se nachází v solích (mořská voda, solná jezera), minerálech jako je sylvín KCl, karnalit KCl*MgCl2*6H2O, draselných živcích. Hydroxid draselný je silná zásada, hygroskopická bezbarvá sůl s leptavými účinky. Pohlcuje oxid uhličitý. Draslík dále vytváří uhličitany, halogenidy, dusičnany, sírany (K2SO4 je průmyslové hnojivo).
Vápník a hořčík
Patří společně s hořčíkem mezi prvky IIA.skupiny - s2 prvky, se dvěma elektrony ve valenčních orbitalech a oxidačním číslem +II. Tato skupina se nazývá kovy alkalických zemin- které jsou tvrdší, křehké a s vyšší teplotou tání a menší reaktivitou než kovy s1 skupiny.
Vápník a hořčích jsou jedněmi z nejvíce rozšířených prvků zemské kůry, jsou složkou minerálů (kalcit, magnezit- v krystalické formě, směs obou je hornina dolomit). Vápník je dále součástí apatitu a fosforitu, fluoridů (CaF2), síranů (sádrovec CaSO4*2H2O), hořečnaté soli jsou rozpuštěné v mořské vodě a slaných jezerech. Jako biogenní prvky jsou součástí chlorofylu- hořčík a vápník krve.
Sloučeniny: oxid vápenatý- pálené vápno, v reakci s vodou tvoří hydroxid vápenatý (hašené vápno). Síran vápenatý- CaSO4 přispívá k „tvrdosti vody“ (ve vodě málo rozpustný). Sádrovec CaSO4*2H2O vypálením ztrácí část molekul vody CaSO4*1/2H2O (sádra). Uhličitan vápenatý je nejčastější ve formě minerálů- kalcit, aragonit, vápenec, popř. mramor, je i součástí křídy.
Krasové jevy jsou způsobeny nerozpustností uhličitanu vápenatého ve vodě a rozpustností e slabých kyselinách (ve vodě, ve které je rozpuštěný oxid uhličitý), což vede k tvorbě rozpustného hydrogenuhličitanu vápenatého(způsobuje přechodnou tvrdost vody).
Jako průmyslová hnojiva se používají ledek vápenatý (Ca(NO3) 2, dusíkaté vápno (CaCN2), vápenaté dihydrogenfosforečnany.
Síra
Patří mezi p4 prvky, kterým do stabilní elektronové konfigurace chybí 2 elektrony, které mohou získat buďto v iontových sloučeninách, nebo vznikem dvou kovalentních vazeb v kovalentních sloučeninách, nebo vznikem dvojné vazby. Síra může mít ve sloučeninách oxidační číslo –II až +VI.
Síra je nekov, který v přírodě může být v čisté formě, nebo ve formě sulfidů FeS2 (pyrit), ZnS, H2S a hydrogensulfidů (redukovaná, -II) nebo oxidů CaSO4*2H2O, MgSO4*7H2O (oxidovaná, +VI). Sulfidy kovů jsou ve vodě nerozpustné, barevné soli.
H2S - Sirovodík je jedovatý plyn se zápachem zkažených vajec, vznikající při rozkladu bílkovin (nebo průmyslovém zpracování koksu, viskózy….). Rozpuštěný ve vodě tvoří slabou kyselinu.
Kyslíkaté sloučeniny- oxid siřičitý SO2 : bezbarvý dráždivý plyn, vznikající spalováním síry, sirovodíku, sulfidů. Redukční činidlo, má dezinfekční účinky. Rozpuštěný ve vodě působí jako slabá kyselina- tvořící soli: hyxdrogensiřičitany, siřičitany. Oxid sírový vzniká oxidací oxidu siřičitého (za přítomnosti katalyzátoru) a s vodou reaguje na kyselinu sírovou.
Kyselina sírová je silná dvojsytná kyselina mísitelná s vodou (exotermní reakce, proto se vždy lije kyselina do vody, ne naopak). Koncentrovaná (98,3%) je silně hygroskopická a dehydratační- organické látky (živé tkáně) jejím působením uhelnatějí. Působí oxidačně zejména za vyšší teploty a reaguje s většinou kovů (kromě olova, zlata a platiny).
Zředěná ztrácí oxidační vlastnosti, ale je kyselejší. Odvozují se od ní (ve vodě rozpustné) soli: sírany a hydrogensírany.
Železo
Kov patřící k přechodným d prvkům VIII. B skupiny, s oxidačním číslem II, stabilněji +III a +VI. Má vysokou hustotu, vysoké teploty tání a varu, je dobře vodivé, relativně měkké, ale křehké a nikoli kujné. Za vyšších teplot reaguje s mnoha prvky (chlorem, kyslíkem, sírou...) V reakci se zředěnými kyselinami tvoří železité soli za současného vytěsnění vodíku z kyseliny.
V přírodě v železných rudách: magnetit (Fe3O4), hematit Fe2O3, limonit (Fe2O3*nH2O), siderit FeCO3), pyrit (FeS2), hydrogenuhličitan železnatý v minerálních vodách. Sloučeniny železa:stálejší jsou železité, než železnaté. Běžně sírany, chloridy, oxidy.
Surové železo –je tvrdé a méně kujné a obsahuje v příměsi uhlík i ve formě karbidu železa. S klesající příměsí uhlíku (do 1,7%) se mění na ocel, která je méně tvrdá, ale kujná. Vlastnosti se pak dále mohou měnit povrchovými úpravami (dosycením niklem, chromem, kobaltem), nebo tepelnými změnami- kalení (rychlé zchlazení) a popouštění (pomalé zahřívání).
Měď
Kov zařazený v I.B skupině, patří mezi d prvky (3d10, 4s1), s oxidačním číslem +I, stabilněji +II.Má vysokou hustotu, vysoké teploty tání a varu, je poměrně dost měkká, dobře vodivé.
V přírodě v měděných rudách např. chalkopyrit CuFeS2, na vlhkém vzduchu vytváří měděnku- hydrogenuhličitan měďnatý. Běžné sloučeniny jsou sírany.
Mangan
Kov patřící mezi přechodné d prvky, s oxidačním číslem +II, +III a +IV, +VI, +VII. Tyto přechodné d kovy mají vysokou hustotu, vysoké teploty tání a varu, jsou tvrdé, křehké, dobře vodivé. S vyšším oxidačním číslem stoupá kyselý charakter jeho kyslíkatých sloučenin (MnO je mírně zásaditý, oxid manganistý silně kyselý).
V přírodě se nachází zejména v kovových rudách - oxidech. Burel (MnO2) se používá ve sklářství, bateriích. Manganistan draselný se používá k dezinfekci (má oxidační účinky.)
Zinek
Kov patřící mezi přechodné d prvky II.B skupiny, s oxidačním číslem +II, s malým podílem elektronů na kovové vazbě. Je měkký, má nízkou teplotu tání. S kyselinou sírovou reaguje vytěsněním vodíku a tvorbou síranu zinečnatého. Běžnými sloučeninami jsou oxidy, sulfidy.
Kobalt
Kov patřící mezi přechodné d prvky, VIII. B skupiny, s oxidačním číslem +II, +III.
Vyskytuje s v sulfidických rudách. Vytváří i mnoho koordinačních sloučenin organického charakteru, je součástí vitamínu B12.
Molybden
Kov zařazený v VI.B skupině, patří mezi d prvky (1s 5d), s oxidačním číslem +I, stabilněji +II. Reaktivnější než ostatní přechodné d prvky, tvoří především oxidy.
Chlor
Cl- patří mezi halogenidy, tj. prvky s výrazně vysokou elektronegativitou. Snadno přijímá elektron a tvoří halogenidový aniont, nebo kovalentní vazbu. Je velmi reaktivní. Za standardních podmínek existuje jako plynná molekula Cl2.
Kyselina Chlorovodíková je složkou žaludečních šťáv. Kyselina chlorná vzniká při chlorování vody a za běžné teploty se rozkládá, přičemž uvolňuje kyslíkový radikál (ničící bakterie). Chlornany vznikají reakcí chloru s hydroxidy a využívají se rovněž jako dezinfekce (chlorové vápno je směs chloridu a chlornanu vápenatého). Kyselina chloristá je jednou z nejsilnějších kyselin a s organickými látkami explozivně reaguje.
Bor
Pevná, málo reaktivní látka, s vlastnostmi polovodiče.Sloučeniny boru a kovů jsou pevné tvrdé a teplotě odolné látky zvané boridy. Sloučeniny boru a vodíku jsou borany. Kyslíkatá sloučenina je např. kyselina boritá H3BO3 (vodný roztok antiseptické účinky- borová voda.
Uhlík
Prvek IV. A skupiny, patřící mezi p2 prvky se 4 elektrony ve valenční vrstvě. Oxidační číslo =IV, +II, +IV. Čistý se vyskytuje ve dvou variantách krystalické mřížka- grafit s vrstevnatou strukturou danou 1 rovinou vazeb a slabými vazbami mezi vrstvami a diamant s prostorově uspořádanými pevnými kovalentními vazbami. Je poměrně málo reaktivní, teplota tání je 3527 °C (3800 K), Ve sloučeninách v uhličitanech (kalcit a magnezit - uhličitan vápenatý a hořečnatý, nebo horniny vápenec a dolomit).
Je poměrně málo reaktivní, reaguje až při vyšších teplotách. Typickou reakcí je oxidace (hoření).
Anorganické sloučeniny: Mezi bezkyslíkaté sloučeniny patří karbidy (sloučeniny uhlíku s prvky s malou elektronegativitou (kovy, Ca, B, Si), se sírou sirouhlík CS2,halogenidy (CCl4), kyanidy (jako soli kyseliny kyanovodíkové HCN).
Kyslíkaté sloučeniny jsou oxidy: CO (produkce spalováním za nedostatku kyslíku), je jedovatý - tím že se váže na hemoglobin pevněji než kyslík. CO2 (dokonalé spalování, dýchání, kvašení, tlení, konečným produktem rozkladu organických látek). Při jeho rozpouštění ve vodě vzniká slabá kyselina uhličitá, který se zahříváním zpětně rozkládá. Kyselina uhličitá tvoří řadu solí – hydrogenuhličitanů (ve vodě rozpustné) a uhličitanů (ve vodě nerozpustné).
2.8 Organické látky
Sloučeniny uhlíku (mimo kyselinu uhličitou a její soli, oxid uhličitý a karbid), z nichž většina obsahuje ještě vodík, často i kyslík, dusík a další prvky. Pokud se jedná jen o sloučeniny uhlíku a vodíku, mluvíme o nich jako o uhlovodících, v případě, že sloučenina obsahuje ještě jiný prvek, je to derivát uhlovodíku. Atomy prvků jsou většinou spojeny kovalentní vazbou a mají charakteristickou vaznost: uhlík 4, dusík 3, kyslík a síra 2, vodík a halogeny 1. Většinou jsou to sloučeniny s nízkou teplotou tání i varu, nevedou elektrický proud, zahříváním za vyšší teploty se rozkládají, rozpouštějí se v organických rozpouštědlech (např. benzen, aceton). Pokud mají molekuly schopné tvořit vodíkové vazby, jsou rozpustné i ve vodě (-OH skupina, aminoskupina, karboxylová skupina).
Jsou podstatnou částí živých organismů a dějů v nich, ale je možné je připravovat i uměle (plasty, pohonné hmoty, barviva, lepidla, léčiva, textilní vlákna…).
Dělí se podle charakteru uhlíkatých řetězců a typů vazeb v těchto řetězcích, případně charakteristických funkčních skupin.
Vazby v organických sloučeninách jsou převážně kovalentní (nepolární) a mohou být jednoduché nebo vícenásobné (dvojná, trojná), přičemž jejich pevnost stoupá s násobným charakterem a současně s ním klesá délka vazby. Pokud má sloučenina násobné vazby označujeme ji jako nenasycenou. Pokud dochází ke kumulaci dvojných vazeb v rámci řetězce, pak se sousedící (nebo prostorově blízké) dvojné vazby navzájem ovlivňují a mají vliv i na prostorovou strukturu molekuly.
Prostorová struktura molekul organických látek souvisí výrazně s jejich prostorovým uspořádáním a v této souvislosti je také používán pojem izomer. Ten označuje sloučeniny se stejným souhrnným vzorcem (počet uhlíků, vodíků…) ale jinou prostorovou strukturou.
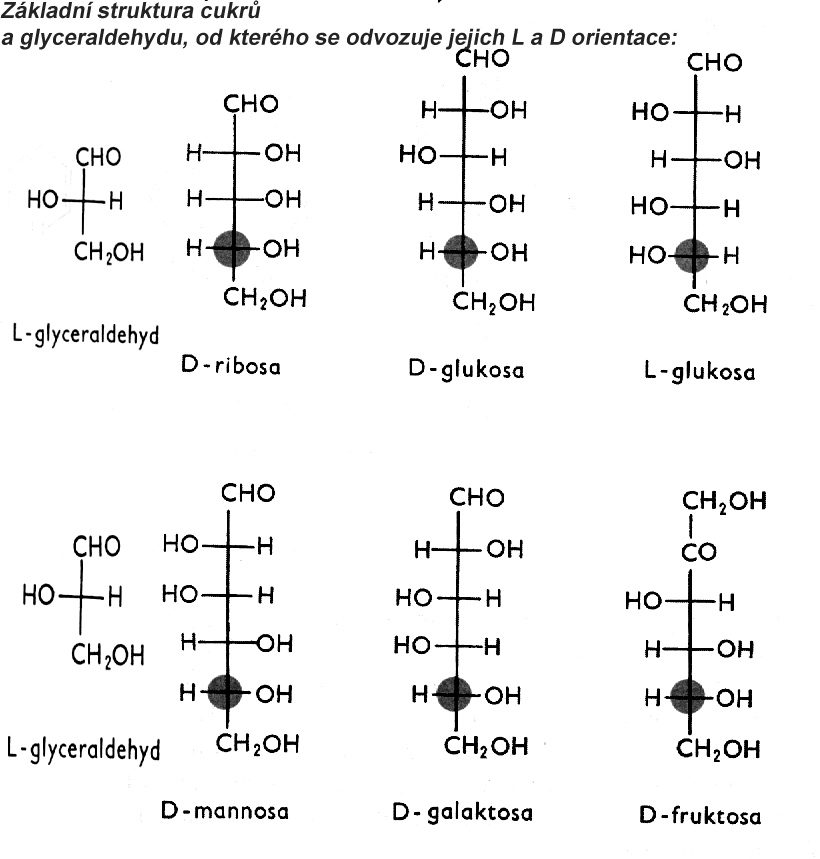
Konfigurační izomery jsou látky se stejným souhrnným vzorcem a jiným prostorovým uspořádáním molekul, přičemž mohou mít některé vlastnosti rozdílné, například jinak lámou polarizované světlo. Stejné funkční skupiny otočené na stejnou nebo různou stranu řetězce se označují jako tzv. cis a trans izomery, levotočivou a pravotočivost se označuje jako L a D konfigurace.
Konstituční izomery jsou látky se stejným souhrnným vzorcem, ale jinou povahou a pořadím vazeb v molekulách, jinými funkčními skupinami. Dále se dělí na izomery řetězcové (rozdíl je ve větvení řetězce a vazbách skupin na uhlíky lineárního řetězce), izomery polohové (vazby funkční skupiny na v pořadí v řetězci rozdílné uhlíky), skupinové (alkohol/keton).
Na Cyklické a necyklické je rozdělení podle tvaru řetězce. lineární- necyklické- mají etězec jednoduchý. Cyklické (aromatické) sloučeniny mají rovinný cyklus, v jehož rámci se střídají jednoduché a dvojné vazby a některé p elektrony náleží nikoli dvojici sousedních atomů spojených vazbou, ale celému řetězci (delokalizované). Typickým příkladem takové sloučeniny je benzen (benzenové jádro).
Cyklické řetězce ale mohou být tvořeny i jednoduchými vazbami, a další dělení je pak na jednoduché monocyklické, polycyklické (spojeno více cyklických řetězců) a heterocyklické (atom uhlíku v rámci cyklu je nahrazen jiným prvkem (často kyslík, dusík).
Názvosloví organických látek
Přehled základních organických látek
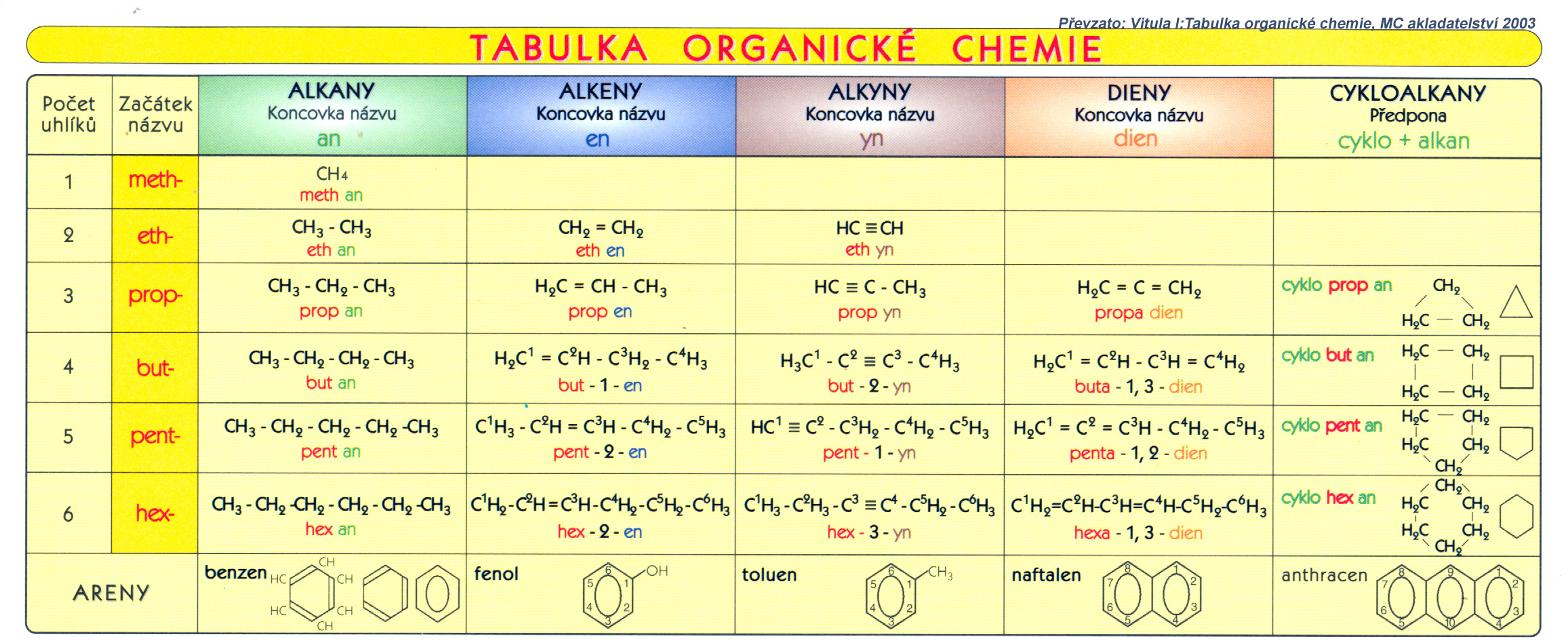
Alkany a cykloalkany
Jsou to lineární nebo cyklické uhlovodíky s atomy uhlíku spojenými jednoduchými kovalentními vazbami, které jsou nepolární.
Reakce alkanů mají radikálový charakter a mezi typické příklady patří oxidace, alogenace, sulfochlorace a krakování.
Oxidace je v případě těchto látek prudká, za uvolnění značného množství tepla (hoření). Spalování alkanů vede ve finále k rozkladu na CO2 a H2O.
Za nedostatku kyslíku může být produktem i CO, za přítomnosti katalyzátorů mohou vznikat karboxylové kyseliny.Chlorace a sulfochlorace vyžaduje ke svému průběhu katalyzátory (UV, teplota...), reaktanty jsou alkany a chlór a produktem jsou halogenidové deriváty). V případě sulfochlorace reaktantem je oxid siřičitý, chlor a alkan, produktem alkansulfonové kyseliny.
Krakování je proces krátkodobého vystavení alkanů vysokým teplotám za nepřítomnosti kyslíku, přičemž výsledkem je rozštěpení uhlíkatých řetězců na kratší uhlovodíky (ethylen, propylen...).
Zástupci jednoduchých uhlovodíků jsou např hořlavé plyny (součást zemního plynu): Methan (CH4)- vznik při mikrobiálním rozkladu organických látek, zejména celulózy, je součástí bahenních plynů, bioplynu
Ethan (CH3CH3), Propan (CH3CH2CH3), Butan (CH3(CH2)2CH3)
Z cyklických například cyklohexan.
Alkeny
Jsou to nenasycené uhlovodíky s jednou dvojnou vazbou mezi atomy uhlíku. Kromě radikálových reakcí (podobně jako u alkanů) docház u aleknů i k reakcím na dvojné vazbě (adice), vedoucím buďto k rozštěpení molekuly v tomto místě, nebo vzniku vazby jednoduché a navázáním např. halogenidu. Adice vodíku na dvojnou vazbu probíhá za přítomnosti katalyzátorů a svou podstatou je radikálová katalytická hydrogenace. Adice halogenidů i vodíku je elektrofilní reakcí.
Alkeny jsou součástí zemního plynu, vznikají při krakování frakcí ropy a používají se pro výrobu plastů (polymerační reakcí).
Alkadieny
Mají dvě dvojné vazby u kterých záleží na umístění v řetězci, které pak ovlivňuje další vlastnosti těchto látek. Pokud jsou řetězci izolovaně, látka se chová jako alken. Pokud jsou v těsném sousedství, ovlivní to možné reakce (adice) na těchto vazbách tak, že dochází k posunu dvojné vazby ke středu molekuly.
Zástupci jsou např. 1,3Butadien a Isopren (2-methyl- 1,3 butadien-)které jsou používány pro výrobu kaučuků (polymerací), Isopren je také základem přírodních látek, isoprenoidů.
Alkiny
Jsou nenasycené uhlovodíky s trojnou vazbou, která umozňuje radikálové i elektrofilní adice, probíhající ve dvou stupních (tvorba dvojné a v dalším stupni jednoduché vazby). Adice vodíku probíhají za katalýzuy (jemně rozptýlený kov), Adice chloru (kys. chlorovodíková jako reaktant) na acetylen vede k tvorbě vinylchloridu (polymerací tvorba PVC), adice vody vede k tvorbě acetaldeydu.
Acetylen (ethin,) byl dříve používán na svícení (arbidové lampy), kde vznikal reakcí vody a karbidu vápenatého (CaC2), vedlejším produktem reakce byl hydroxid vápenatý. Acetylen se také používá ke sváření.
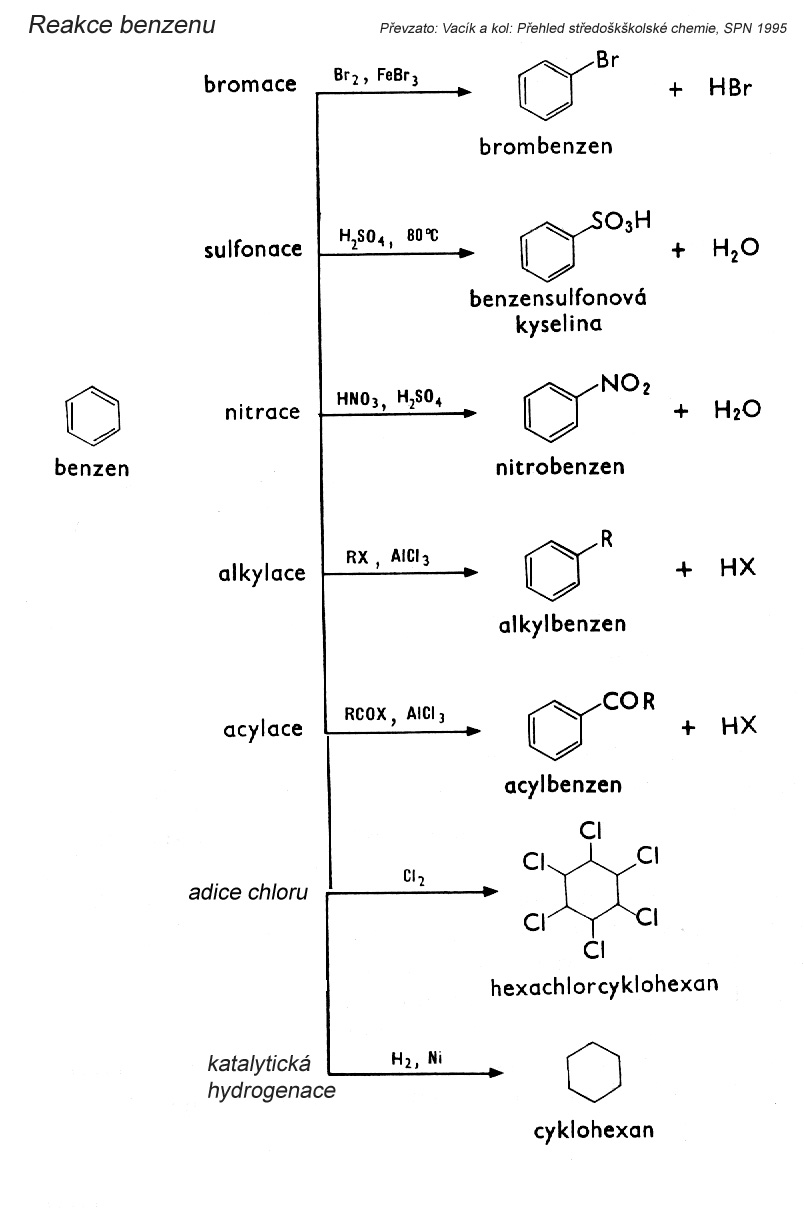
Areny
Aromatické uhlovodíky jsou cyklické uhlovodíky obsahující benzenové jádro. Jejich reakce jsou opět radikálové, s kyslíkem oxidují (hoří), reagují i s halogenidy, další typickou reakcí je pro ně elektrofilní substituce aromatického jádra. Oxidace probíhá buďto na postranních řetězcích nebo na jádře, a finálním produktem je karboxyl.
Zástupci jsou: benzen (C6H6),Toluen C6H5CH3 které se získávají z ropy, z uhlí nebo dehydrogenací cyklohexanu. S jedním benzenovým jádrem - benzen, dvě benzenová jádra - naftalen, tři benzenová jádra anthracen.
Základní rozdělení derivátů uhlovodíků
Kyslíkaté deriváty uhlovodíků
Alkoholy Jeden z vodíků lineárních uhlovodíků nahrazen -OH skupinou, mají dobrou rozpustnost ve vodě, vysokou teplotu varu, působením silných bází z OH skupiny odštěpují proton, mohou tvořit vodíkové vazby.
Podle charakteru vazebných párů uhlíku, na který je vázána OH skupina, je dělíme na primární, sekundární, terciální (tři navázané C + OH skupiny jako čtvrtý vazebný pár), přičemž toto rozdělenéí obrážíi snížení oxidovatelnosti. S alkalickými kovy tvoří zásadité soli- alkoholáty. Mohou se oxidovat na aledhydy, nebo ketony, v dalším stupni na karboxylové kyseliny.
Známými zástupci je methanol (prudce jedovatý, použitelný jako rozpouštědlo), ethanol (líh), cyklohexanol (výroba syntetických vláken), ethylenglykol (1,2ethandiol- nemrznoucí směsi), glycerol-(1,2,3-propantriol, kosmetika, potravinářství).
FenolyJeden z vodíků aromatických uhlovodíků nahrazen -OH skupinou, z OH skupiny odštěpují proton snadněji než alkoholy, jsou tedy kyselejší. S hydroxidy alkalických kovů vytvářejí soli- fenoláty (bazická nukleofilní činidla). Pokud mají jen jednu hydroxylovou skupinu, jsou poměrně stálé, s dvěma skupinami se snadněji oxidují a vytvářejí enasycené ketony (chinony, barevné).
Známými zástupci jsou: Fenol (má šestiuhlíkaté aromatické jádro s jednou hydroxylovou skupinou, důležitá surovina pro výrobu plastů a aromatických sloučenin), Kresoly (hydroxideriváty toluenu a s dezinfekčními účinky).
Ethery s funkční skupinou -O-, dvojvazným kyslíkovým atomem, na který se váží dva uhlovodíkové adikály.Jsou těkavější než alkoholy, s kyslíkem tvoří explozivní peroxidy,ve směsi se vzduchem jsou výbušné, se silnými anorganickými kyselinami tvoří oxoniové soli.
Ethylenoxid (CH2)2)O, jedovatý plyn který se účinkem vody štěpí na glykol; Diethylether- narkotikum.
Karbonylové sloučeniny funkční skupinou je uhlík s volným elektronovým párem a dvojnou vazbou na kyslík >C=O . Vzhledem k elektronegativitě kyslíku je tato skupina polární a kyslík má částečně záporný náboj, zatímco uhlík částečně kladný. Karbonylová skupina působí na sousední atomy vodíku, zvyšuje jejich odštěpitelnost a tím i kyselý charakter sloučeniny. Typickou reakcí jsou nukleofilní a elektrofilní adice. Oxidací vznikají karboxylové kyseliny (z aldehydů), redukcí vznikají primární nebo sekundární alkoholy.
Aldehydy Mají k uhlíku v karbonylové skupině >C=O vázán jeden radikál a jeden atom vodíku, Ketony mají k tomuto uhlíku vázány dva radikály (jsou méně reaktivní než aldehydy).
příkladem je formaldehyd (methanal), štiplavý plyn rozpustný ve vodě kde má dezinfekční účinky a jeho roztok- formalín (40%) vede k denaturaci bílkovin. Acetaldehyd (ethanal) těkavá kapalina použitelná k výrobě butanolu, kyseliny octové...Benzaldehyd C6H5OH je rovněž surovinou pro chemické výroby a kyselinu benzoovou. Aceton (propanon)je jedovaté rozpouštědlo, jehož páry ve směsi se vzduchem jsou hořlavé.)
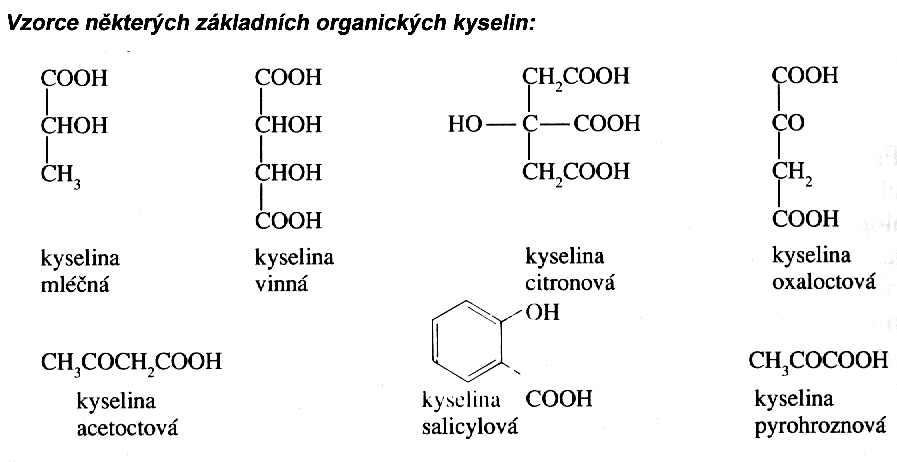
Karboxylové kyseliny mají funkční skupinu -COOH (jednu nebo více, monokarboxylové, dikarboxylové, trikarboxylové)a patří mezi nejkyselejší organické sloučeniny. Reagují s hydroxidy alkalických kovů za vzniku solí karboxylových kyselin, ze kterých lze reakcí se silnou anorganickou kyselinou substitucí zpětně vytěsnit karboxylovou kyselinu. V reakci s alkoholy poskytují estery. Při zahřívání mohou uvolňovat oxid uhličitý a vodu.
Kyselina mravenčí (methanová, HCOOH)je leptavá kapalina použitelná jako konzervant. Kyselina octová (ethanová,CH3COOH)- ocet je její 5% roztok. Kyselina máselná (butanová, CH3(CH2)2COOH)vzniká při žluknutí másla, je součástí látek obsažených v potu. Kyselina palmitová CH3(CH2)14COOH), stearová (CH2)16COOH) a nenasycená kyselina olejová CH3(CH2)7=(CH2)7COOH) jsou součástí rostlinných tuků ve formě esterů s glycerolem. Kyselina šťavelová (COOH)2 patří mezi dikarboxylové kyseliny, tvoří ve vodě rozpustné rystaly, ve formě solí-šťavelanu vápenatého - je přítomná v rostlinných pletivech. Kyselina maleinová (cis butendiová kyselina) Patří mei aromatické kyseliny, vyrábí oxidací cyklohexanolu a využívá se ve výrobě syntetických vláken. Kyslina benzoová (C6H5COOH)se využívá jako konzervační prostředek a surovina pro chemickou výrobu aromatických sloučenin. Kyseliny ftalová a tereftalová (1,2-benzendikarboxylová kyselina a 1,4-benzendikarboxylová kyselina) jsou důležité pro výroby plastů a syntetických vláken.
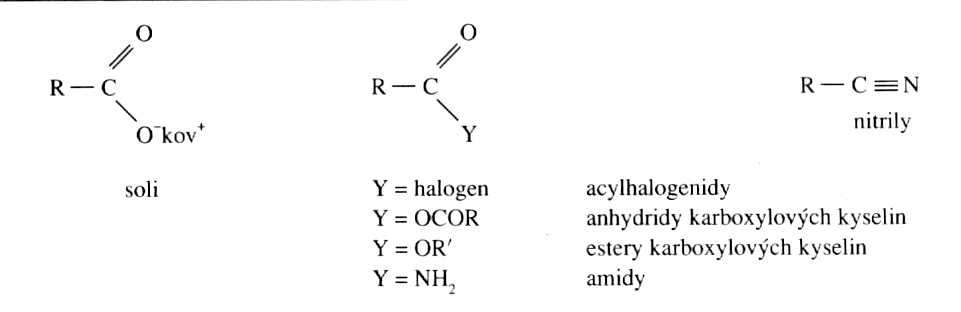
Deriváty karboxylových kyselin mají funkční skupinu odvozenu od -COOH po odštěpení OH. R-C=O s volným vazebným místem na uhlíku se nazývá acyl ,
(u prvních dvou monokarboxylových kyselin- mravenčí a octové- je to formyl a acetyl).Mezi nejraektivnější deriváty patří acylchloridy a anhydridy karboxylových kyselin.
Dalšími deriváty mohou být amidy a nitrily.
Reakcemi karboxylových kyselin s alkoholy vznikají estery,estery vyšších karboxylových kyselin s glycerolem jsou základní složkou tuků a rostlinných olejů. Alkalická (NaOH, KOH) hydrolýza těchto tuků je podstatou výroby mýdla.
Dalším typem derivátů jsou ty, kde nedochází ke změně funkční skupiny kyselin, ale k vyzbě další funkční skupiny na uhlíkatý řetězec.
Příkladem jsou aminokyseliny (aminoskupiny -NH2), halogenokyseliny (halogenid vázaný na uhlík sousedící s COOH skupinou), hydroxikyseliny (hydroxylová skupina-OH), ...
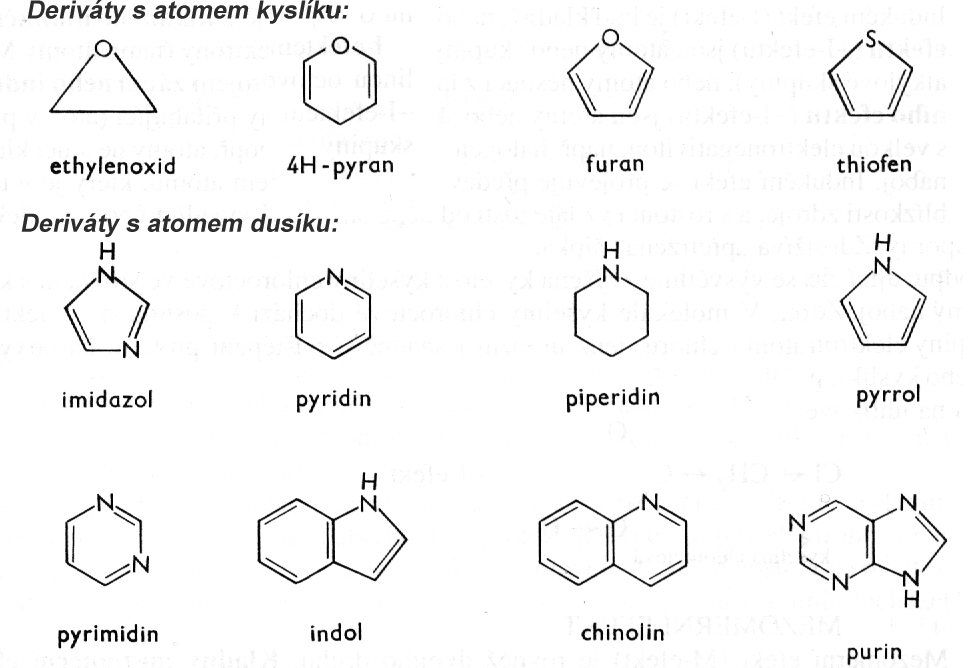
Heterocyklické sloučeniny se tak nazývají proto, že součástí cyklického uhlíkatého řetězce je i atom (nebo více atomů) jiného prvku, který uhlík svou vazností může nahradit (je dvoj, troj, čtyřvazný), nejčastěji tímto atomem je kyslík nebo dusík, případně síra.Tyto heterocykly mohou mít aromatický charakter (delokalizované elktronyx v jádře cyklu). Velká část těchto heterocyklů je součástí látek důležitých pro živé organismy: sacharidy, dusíkaté báze jako součást DNA, vitamíny, hormony alkaloidy, barviva....
Halogenové deriváty
Deriváty uhlovodíků obsahující jednovaznou halogenovou skupinu (Cl, B, F). Alkylhalogenifdy jsou obecně reaktivnější, než původní ulovodík (i než uhlovodík s aromatickýcm jádrem) a jeich reaktivita stoupá od alkylfloridu k alkyljodidu.
Typickou reakcí je nukleofilní substituce a díky tomu se vzhledem ke svým vlastnostem některé z nich používají jako rozpouštědla, nebo k chemickému čištění.
Methylchlorid CH3Cl - používá se v chladících zařízeních; Chloroform trichlormethan, rozpouštědlo, využíval se k narkózám; Vinylchlorid Chlorethen - základ pro výrobu polyvinylchloridu - PVC; Chloropren 2chlor-1,3butadien, používá se k výrobě kaučuku; Tetrafluorethylen jeho polymer je základem teflonu; Jodoform trijodmethan - má dezinfekční účinky.
Deriváty uhlovodíků se skupinou obsahující dusík
Nitrosloučeniny Nitroskupina -NO2. Redukcí nitrosloučenin (nitrobenzen) vznikají aminy. Nitrobenzen - používá se k výrobě anilinu. Trinitrotoluen - trhavina.
Aminy Nitroskupina -NH2, dají se považovat za deriváty uhlovodíků a amoniaku. Protože je v nich N trojvazný, může mít naraen 1, 2 nebo 3 vodíky uhlovodíkovým radikálem. Dusík má nevazebný elektronový pár a díky tomu mají aminy zásadité a nukleofilní vlastnosti. Aromatické aminy mohou vytvářet velmi reaktivní diazoniové soli a z nich pak azobarviva.
Chemické reakce v organické chemii
Základní druhy chemických reakcí
Radikálové substituce jsou typické pro sloučeniny s nepolárními kovalentními vazbami. Podstatou je symetrické štěpení kovalentní vazby mezi C-C, případně C-H. Pro počátek reakce je potřeba dodat energii (vysoké teploty, UV záření). Meziproduktem jsou radikály - molekuly s volným elektronem, které jsou v nestabilním stavu a tudíž velmi reaktivní. Příkladem může být reakce alkanů s halogenidy.
Elektrofilní substituce jsou typické pro areny. V průběhu reakce vzniká elektrofilní činidlo (iont chloru, bromu, síranový nebo hydrogensíranový aniont, methyl), které se pak přechodně váže na volné elektrony benzenového jádra a později stabilně na atom uhlíku benzenového jádra. Příkladem může být nitrace - reakce benzenového jádra s dusičnanovým iontem, bromace, sulfonace, methylace...
Nukleofilní substituce jsou reakce probíhající na uhlíkových atomech v těsném sousedství skupiny, která ovlivňuje rozložení elektronů (odpuzuje- např. halogenidy), čímž vzniká na uhlíku částečně kladný náboj. Nukleofilní činidla je např. -OH skupina.
Eliminace jsou reakce, při nichž dochází k odštěpení malých mokelul (vody\, alkoholu, halogenovidíku)z delšího uhlíkatého řetězce (např, vznik cyklohexenu z cyklohexanolu za katalýzy silnou anorganickou kyselinou).
Elektrofilní adice jsou reakce, při nichž dochází k reakci mezi elektrony násobné vazby nenasycených uhlovodíků a elektrofilním činidlem (halogeny, halogenovodíky, kyselina sírová).
Nukleofilní adice jsou reakce při nichž dochází k vazbě na dvojnou vazbu C=O, respektive při zrušení této vazby na uhlíkový atom (díky větší elektronegativity yslíku má částečně kladný náboj), na který se mohou navázat: voda, alkohol, amoniak, dusíkaté a sirné sloučeniny...).
Esterifikace je reakcí karboxylových kyselin s alkoholy (často za katalýzy silnou anorganickou kyselinou). Probíhá v mezistupních protonované karboxylové kyseliny a zpětný průběh této reakce se nazývá hydrolýza esteru.
Přesmyky podstatou je změna prostorové struktury molekuly na izomer (s jinou strukturou ale stejným chemických složením a jinou reaktivitou).
Katalyzátory
Katalyzátory biochemických reakcí jsou látky,které umožňují živým organismům regulovat a řídit metabolické procesy.
Typickými katalyzátory v živých organismech jsou Enzymy . Svou strukturou jsou tyto látky proteiny, ale často obsahují i nebílkovinnou část molekuly (tzv. kofaktor), což jsou často ionty kovů (Mg, K, Fe, Zn, Cu) nebo složitější organické molekuly tzv. koenzymy). Základní rozdělení enzymů je podle typu katalyzovaných reakcí a podle těchto reakcí se i tvoří jejich názvosloví přidáním koncovky -asa.
- Transferasy katalyzují přenos funkčních skupin mezi molekulami.
- Isomerasy katalyzují prostorové a funkční změny v rámci jedné molekuly.
- Oxidoreduktasy katalyzují přenos elektronů, vodíku, nebo reakce s kyslíkem.
- Hydrolasy katalyzují hydrolytické štěpení vazeb.
- Lyasy katalyzují nehydrolytické a neoxidační štěpení vazeb, případně adici na násobné vazby.
- Ligasy katalyzují syntézu spojenou se štěpení ATP.
Funkce enzymů spočívá především ve snížení aktivační energie (případně i teploty) nutné pro počátek reakce, současně může docházet ke zvýšení rychlosti této reakce. Podstatou je vytvoření komplexu enzym-substrát (vazbou substrátu na aktivní centrum enzymu) před započetím reakce a rozpadu tohoto komplexu v průběhu reakce (enzym tedy není spotřebováván). Enzymy jsou silně specifické - katalyzují přeměnu jedné látky určitým způsobem a současně nepůsobí na látky velmi podobné (nevznikají nežádoucí vedlejší produkty).
Na aktivitu enzymů mají vliv faktory prostředí: teplota, pH, látky v okolním prostředí, koncentrace reaktantů a produktů...
Teplota zpočátku může zvyšovat průběh katalyzované reakce, ale po dosažení teplotního optima, další zvyšování teploty vede k poklesu rychlosti reakce (nebo jejímu zastavení) v souvislosti se změnou struktury- denaturace bílkovinné podlednotky enzymu.
Acidita prostředí - pH - působí podobně, enzymy mají obvykle pH-optimum - neboli rozsah pH, ve kterém reakce probíhá nejrychleji - a mimo tento rozsah se rychlost průběhu reakce zastavuje nebo zpomaluje, obvykle v souvislosti s disociací skupin v aktivním centru enzymu.
Látky ovlivňující aktivitu enzymů se nazývají podle svého účinku inhibitory (brzdí nebo zastavují činnost enzymu) a aktivátory(zvyšují činnost enzymu), přičemž odstatou může být chemická reakce - modifikace enzymu v reakčním centru, případně kompetice v rámci chemické reakce do které se enzym zapojuje - vytěsnění enzymu z komplexu enzym-substrát, nebo znemožnění vytvoření tohoto komplexu.
Aktivitu enzymů mohou ještě ovlivňovat tzv. regulační enzymy (po navázání na enzym změní jeho konformaci a tím i aktivitu) a případně produkty nebo reaktanty katalyzované reakce, které také navázáním mohou měnit enzym z neaktivního na aktivní a naopak.
Základní skupiny organických látek v živých organismech
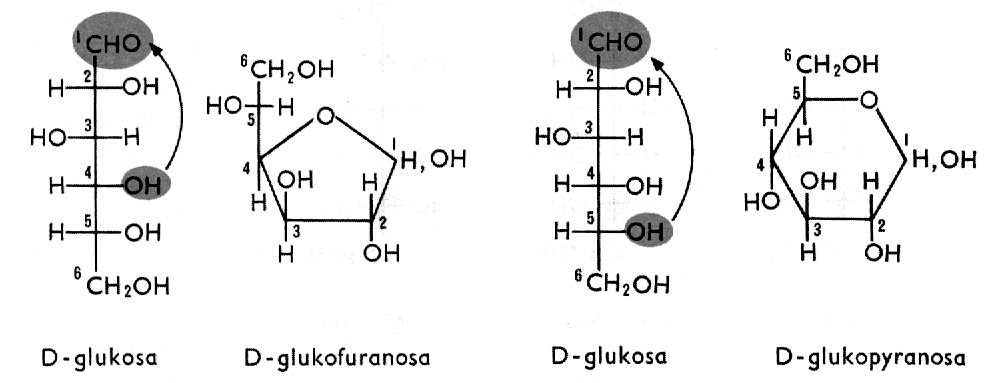
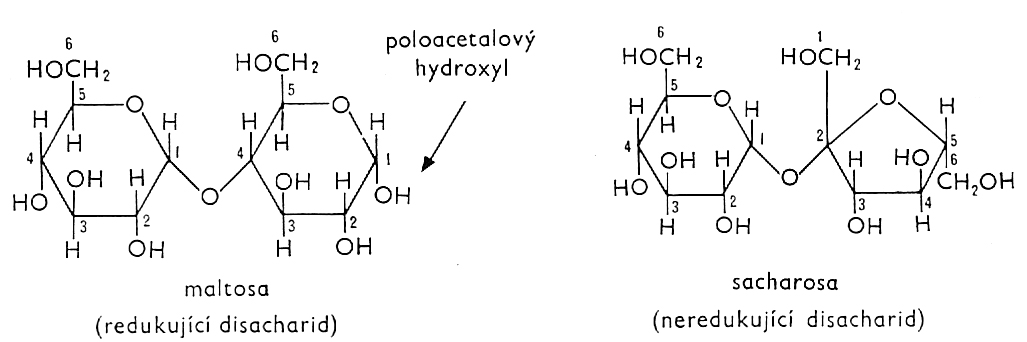
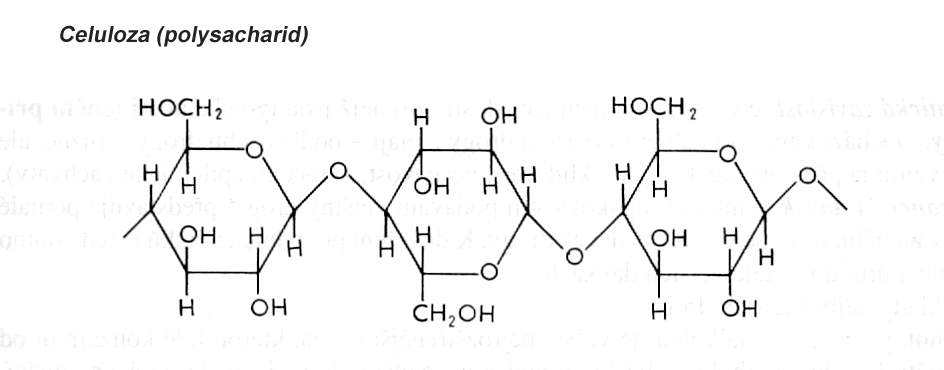
Cukry - Sacharidy
Podle struktury molekuly se dělí na monosacharidy, oligosacharidy (obojí rozpustné ve vodě a sladké) a polysacharidy. Strukturně je možné je definovat jako hydroxyaldehydy nebo hydroxyketony (tj. uhlíkaté sloučeniny obsahující atom kyslíku vázaný dvojnou vazbou na uhlík. Podle počtu uhlíkových atomů se označují jako triozy(3), tetrosy, pentosy, hexosy (6), heptosy. Mohou mít lineární, nebo cyklický řetězec. Ten se vytváří velmi snadno adicí hydroxylové skupiny na aldehydovou, nebo ketonovou skupinu (vzniká poloacetalový hydroxyl ve kterém má primární uhlík heterocyklu vazbu na o heterocyklu, sousední uhlík, vodík a OH skupinu) a je to forma ve které se vyskytuje většina pětiuhlíkatých- furanosy a šestiuhlíkatých- pyranosy. Další rozdělení je podle prostorového uspořádání hydroxyskupin v lineárním řetězci - jako L- a D- izomery (podle konfigurace blízké L nebo D glyceraldehydu).
Monosacharidy jsou redukční činidla, stálá v kyselém a nestálá v zásaditém prostředí. Účinkem alkoholů se mění na glykosidy (vodíkový atom poloacetalového hydroxylu je nahrazen uhlovodíkovým zbytkem. např methylem), což jsou acetaly stálé v alkalickém a nestálé v kyselém prostředí. V přírodě dchází k tvorbě jejich dusíkatých derivátů -nukleosidy(vodíkový atom poloacetalového hydroxylu je nahrazen uhlovodíkovým zbytkem vázaným přes atom dusíku, přičemž tímto bytkem je purinová nebo pyrimidinová báze).
Příkladem důležitých monosacharidů je D-Glukosa, tzv. hroznový cukr, který je složkou mnoha oligo- a polysacharidů a současně energetickým zdrojem živých organismů. D-galaktosa je součástí mléčného cukru, disacharidu laktosy. D-Fruktosa, ovocný cukr,obsažený také v medu, je podjednotku sacharosy (spolu s D-glukosou).Dále je důležitá D-ribosa a 2deoxy-D-ribosa jako základní stavební kameny nukleových kyselin.
Oligosacharidy se vytváří spojením dvou a více monosacharidových jednotek glykosidovými vazbami. Kyselou hydrolýzou je možné monosacharidy opět uvolnit. Dělí se na redukující a neredukující podle toho, jestli mají alespoň jeden poloacetalový hydroxyl.
Nejdůležitějšími disacharidy jsou Maltosa, složená ze dvou glukosových jednotek (získává se hydrolýzou škrobu), Laktosa,mléčný cukr, složená z D-glukosové a D-galaktosové jednotky, Sacharosa řepný a třtinový cukr, tvořená spojením D-glukosy (pyranosy) a D-fruktosy (furanosy) glykosidovou vazbou přes dva poloacetaly.Sacharosa je neredukující disacharid a hydrolýzou kyselinami se rozpadá na D-glukosu a D-fruktosu.
Polysacharidy jsou polymery monosacharidů s počty podjednotek řádově stovky a tisíce. Jsou převážně neredukující a ve vodě špatně rozpustné. Opět se mohou rozpadat a menší odjednotky, nebo odštěpovat monosacharidy kyselou hydrolýzou.
Jedním z nejdůležitějších je škrob, tvořený D-glukosovými jednotkami spojenými glykosidovou vazbou (1-4). Rostlinný škrob se skládá z amylosy a amylopektinu (přičemž amylosa je lineární D-glukan, amylopektin má makromolekuly rozvětvené na 6. uhlíku glukosy).
Glykogen je zásobním polysacharidem savců, tvořeným rozvětvenými makromolekulami D-glukosových podjednotek.
Celulosa je rovněž D-glukan, nerozpustný ve vodě, rozdíl oproti výše uvedeným D-glukanům je v typu vazby, která není alfa(1-4), ale beta(1-4). Je hlavním stavebním materiálem buněčné stěny vyšších rostlin.
Pektiny jsou dalším příkladem složitých polysacharidů, podobně jako rostlinné kleje, klovatiny. Polysacharidy obsahující dusík jsou např. chitin (součást kostry členovců, buněčné stěny hub) a aminopolysacharidy, jejichž příkladem je heparin (srážlivost krve).
Tuky
Jsou estery vyšších mastných kyselin a hydroxy- nebo amino- sloučenin. Jedna ze skupin lipidů jsou Acylglyceroly estery mastných kyselin (alifatické monokarboxylové kyseliny-palmitová, stearová, olejová) a glycerolu (1,2,3-propantriol). Podle počtu esterovaných hydroxiskupin v glycerolu se označují jako mono-, di- a triacylglyceroly
Jsou nerozpustné ve vodě, vodu odpuzují (jsou hydrofobní) a často lehčí než voda. Pokud jsou pevné, nazývají se tuky, kapalné oleje.
Další skupina Vosky jsou estery mastných kyselin a vyšších alkoholů (20 a více uhlíků v molekule)
V živých organismech mají řadu funkcí, z nichž nejvýznamnějšími je to, že jsou součástí biomembrán všech živých buněk (fosfolipidová dvojvrstva tvořená tuky s estericky vázanou kyselinou fosforečnou), což udává základní vlastnosti buněk - a současně jsou využívány jako zásobní energetické látky. Nenasycené mastné kyseliny - linolová a linolenová (součást rostlinných olejů) jsou důležitou součástí naší potravy.
Známými reakcemi tuků je tvorba mýdla - hydrolýza acylglycerolů silným hydroxidem (NaOH, KOH), přičemž výsledkem reakce jsou soli mastných kyselin-mýdla (R-COO-Na).
Pokud jsou v olejích a tucích ve větším množství nenasycené kyseliny, pak na vzduchu (v tenké vrstvě) může docházet ke štěpení dvojných vazeb a tvorbě polymerů spojováním molekul kyslíkovými můstky. Obecně jsou dvojné vazby v molekulách tuků méně stabilní a stálé- a podstatou potravinářského ztužování tuků, které vede k jejich větší trvanlivosti, je právě adice vodíku na dvojné vazby(katalyzovaná niklem).
Bílkoviny
Jedná se o látky se strukturou polypeptidového řetězce, tj. aminokyselin spojených peptidickou vazbou (reaguje alfa aminoskupina jedné a karboxylová skupina druhé aminokyseliny).
Aminokyseliny, jako stavební jednotky bílkovin (je jich 20), jsou typické aminoskupinou v poloze alfa vůči karboxylu (vázané na první uhlík řetězce pokračujícího skupinou R)a dále mají L-konfiguraci. Liší se skupinou R, podle které se dělí na: kyselé (2 COOH skupiny v molekule), bazické (s větším počtem atomů dusíku), nepolární (hydrofobní), polární (rozpustné ve vodě). Aminokyseliny mají vždy minimálně 2 skupiny schopné disociace- amino skupinu a karboxylovou skupinu- přičemž záleží na pH prostředí jestli jsou nebo nejsou vyrovnány elektrické náboje. Bod nulového náboje molekuly je tzv. izoelektrický bod, charakterizující zároveń minimální rozpustnost aminokyseliny ve vodě.
Primární struktura bílkovin ja dána pořadím aminokyselin v řetězci, které zároveň určuje vlastnosti celé molekuly. (polypeptidy označujeme řetězce s délkou do 100 aminokyselin, bílkoviny nad 100 aminokyselin).
Prostorová struktura bílkovin spočívá v uspořádání řetězců mezi sebou navzájem a je závislá na pořadí a zastoupení jednotlivých aminokyselin (tendence aromatických částí aminokyselin směřovat do centra molekuly) a na tzv. disulfidových můstcích mezi dvěma zbytky cysteinů a vodíkových vazbách mezi atomem vodíku NH skupiny a kyslíku C=O karboxylové skupiny a iontových interakcích negativně a pozitivně nabitými skupinami. Jednoduchá je struktura vláknitá (fibrilární)) lineárním uspořádáním řetězců s vysokou pevností a malou rozpustností (proteiny kůže, svalových vláken, vlasů). Globulární strukturu tvořící kompaktní kulovitý tvar, s dobrou rozpustností. Šroubovice je tvar tvoření svinutím řetězce propojením vodíkovými vazbami mezi skupinami každé čtvrté aminokyseliny v řetězci (většinou pravotočivá alfa helix). Skládaný list je stablizovaná struktura s rovnoběžným uspořádáním polypeptidových řetězců a R skupinami nad a pod rovinou listu.
Terciální struktura je pak prostorové uspořádání celého polypetidového řetězce. Oligomery jsou bílkoviny tvořené více polypeptidovými řetězci. Uspořádání molekuly bílkoviny v organismu se označuje jako nativní stav.Denaturace bílkoviny je pak změna jejího prostorového uspořádání porušením vodíkových a sirných můstků (může a nemusí být vratná), což může být způsobeno změnou pH (často vratná) nebo teplotou (většinou nevratná).
Nukleové kyseliny
Jsou látkami, které umožňují přenos genetické informace mezi generacemi organismů a ve svém pořadí dusíkatých bazí kódují strukturu bílkovin jako základních stavebních jednotek organismů a základních molekul regulujících a řídících průběh metabolismu (enzymů a kofaktorů enzymů) a všech životních procesů v buňkách a organismech. Jsou obsaženy v jádře buněk, RNA i v mitochondriích, chloroplastech, ribozómech.
DNA a RNA Deoxyribonukleotidová kyselina má formu dvojité šroubovice a RNA- ribonukleotidová kyselina ve formu jednoduchého řetězce také ve tvaru šroubovice (360 stupňů v řetězci šroubovice je dosaženo po 10 nukleotidech v řetězci). Tento řetězec je mimo stav dělení buňky navinut na specifické bílkoviny- histony - a dále tvoří zvláštní jednotky- chromozómy. Stavebními jednotkami nukleových kyselin jsou nukleotidy, tvořené cukernou složkou (ribózou nebo deoxyribózou), dusíkatou bází (pyrimidinovou nebo purinovou) a fosfátovým zbytkem .Spojení těchto podjednotek- nukleotidů- je přes cukernou složku jednoho a fosfátovou složku dalšího nukleotidu. Dusíkaté báze jsou v DNA 4- deriváty purinu: adenin a guanin a deriváty pyrimidinu: cytosin a thymin, s tím, že v RNA je thymin nahrazen uracilem.Vazebné možnosti existují vždy mezi tzv. komplementárními bazemi- jednpu purinovou a jednou pyrimidinovou, kde je vazba vodíkovým můstkem mezi vodíkem NH2 skupiny a kyslíkem vázaným dvojnou vazbou na uhlík cyklického řetězce, v těsném sousedství dusíku. Navzájem semohou vázat adenin s thyminem(popřípadě uracilem) a cytosin s guaninem.
Vitamíny
Vitamíny jsou látky nezbytné pro správné fungování živých organismů, často ovlivňují správný průběh biochemických reakcí jako katalyzátory (jsou součástí nebo tvoří koenzymy), pomáhají organismu zbavovat se toxických produktů metabolismu ( např. jako antioxidanty).
Poměrně heterogenní skupina látek,jejichž základní rozdělení je podle rozpustnosti ve vodě nebo v tucích. Rozpustné v tucích: A,D,E,K. Vitamín A - strukturně diterpen. Vitamín D - strukturně velmi podobný cholesterolu (vzniká z ergosterolu UV zářením). Rozpustné ve vodě: B1,B2,B6,B12, kyselina nikotinová, panthotenová, listová, askorbová(C). Thiamin -B1 - účastní se přenosu aldehydu. Riboflavin-B2 účastní se přenosu vodíku, stejně jako kyselina nikotinová. Biotin- vitamín H- účastní se přenosu karboxylové skupiny. Pyridoxin-B6 -účastní se přenosu aminoskupiny. Kyselina panthotenová- účastní se přenosu acylového zbytku. Kyselina listová ovlivňuje přenos uhlíkových zbytků. Kyselina askorbová-C vitamín- ovlivňuje hydroxylaci.
Hormony
Hormony obecně jsou látky, které umožňují řídit a korigovat procesy v živých organismech, umožňují načasovat a propojit reakce v organismu tak, aby fungoval jako jeden celek, nikoli soubor nezávislých buněk, pletiv, nebo tkání. U rostlin jsou jediným řídícím mechanismem, u živočichů se na řízení podílejí spolu s nervovou soustavou.
Chemické složení hormonů je různé: steroidy, peptidy, proteiny, fenoly... Princip jejich působení je ve vazbě na membránové receptory (bílkoviny v biomembráně).Komplex receptor-hormon pak může aktivovat specifické enzymy (inhibitory nebo aktivátory enzymů)řídící průběh reakcí v buňce.
Steroidy Strukturním základem je tetracyklická látka zvaná steran, nebo cyklopentanoperhydrofenanthren, tvořený třemi šestiuhlíkatými a jedním pětiuhlíkatým cyklem.
Steroly jsou steroidy, u kterých je funkční skupinou hydroxyl. Příkladem je cholesterol, jako funkční základ tvorby dalších hormonů v živočišném těle.
Žlučové kyseliny ,jsou steroidy, které ve formě solí slouží jako emulgátory usnadňující vstřebávání tuků ve střevě.
Steroidní hormony jsou např. testosteron, estradiol a progesteron jako lidské pohlavní hormony. Kortikoidní hormony mají rovněž podobnou strukturu, vytváří se v kůře nadledvin a řídí metasbolismus cukrů a vodní režim v těle (přes transporty iontů draslíku a sodíku).
Jsou látky obsažené v rostlinných i živočišných tělech.
Isoprenoidy
Strukturním základem těchto látek je 2-methyl,1,3-butadien.
Terpeny jsou látky obsažené zejména v rostlinách. Vznikají spojováním2 a více isoprenových jednotek (monoterpeny -2 jednotky, seskviterpeny-3, diterpeny-4, triterpeny-6...polyterpeny...). Mohou být i cyklické/polycyklické a současně může jít o kyslíkatéderiváty (alkoholy, ketony, aldehydy, karboxylové kyseliny).
Směsí terpenů v rostlinách jsou silice. Monoterpenem je např menthol, nebo kafr. Triterpeny jsou přírodní pryskyřice. Tetraterpeny jsou např karotenoidy. Polyterpenem je přírodní kaučuk.
Alkaloidy
Strukturním základem těchto látek jsou heterocyklické sloučeniny (s velmi různorodou strukturou) tvořené i více cykly a obsahující v molekulách alespoň jeden atom dusíku, díky kterému mají bazický charakter (s kyselinami tvoří soli).
Vznikají v některých druzích rostlin jako produkty metabolismu, jako látky chránící rostlinu proti konzumentům apod. Mohou ovlivňovat řízení a průběh biochemických procesů v živých organismech. Příkladem alkaloidů jsou morfin,kofein, nikotin, atropin,kokain, námelové alkaloidy podobné LSD.
2.9 Metabolismus - Základní procesy v živých organismech
Základní rozdělení metabolických procesů je na katabolické procesy vedoucí obecně k rozkladu složitějších látek (příkladem třeba dýchání) a anabolické procesy vedoucí k syntéze složitějších látek a molekul (fotosyntéza, proteosyntéza). Tyto procesy navzájem mají různé průběhy chemických reakcí (jiné typy a průběhy reakcí jsou využívány pro syntézu a jiné pro rozklad) a probíhají často i v jiných organelách (katabolismus v mitochondriích, anabolismus v cytoplazně, golgiho aparátu, endoplazmatickém retikulu).
Podle zdrojů energie a zdrojů základního stavebního prvku - uhlíku - se organismy dělí na autotrofní (fotoautotrofní) využívající jako zdroj energie světlo a jako zdroj uhlíku oxid uhličitý, a chemotrofní, získávající energii z energie vazeb v chemických sloučeninách. Chemolitotrofní využívají energii vazeb anorganických látek (sirovodík,amoniak, sloučeniny železa)- a patří tam sirné, amonné, železité bakterie. Chemoorganotrofní- heterotrofní- využívají jako zdroj energie i uhlíku organické látky.
Energie chemických vazeb není využívána přímo, ale je v organismech nejprve poutána v energeticky bohatých molekulách ATP (adenosintrifosfátu), což je látka s energeticky bohatou fosfátovou vazbou. Tato vazba snadno vzniká a snadno se i hydrolyzuje, za opětovného uvolnění vázané energie (20,3kJ/mol). Tato energie je využívána v anabolických procesech, ale i v dalších procesech organismu nutných k udržení základního metabolismu a života. Vznik ATP je součástí procesu využívání energie organických látek v procesu jejich oxidace (prodýchávání).
Fotosyntéza
Fotosyntéza je procesem, kterého jsou schopné jen autotrofní organismy (využívající jako zdroj uhlíku oxid uhličitý).
6 CO2 + 12 H2O -+-> 2838 kJ = 42 světelných kvant ---> C6H12O6 + 6O2 + 6 H2O přičemž uvolněný molekulový kyslík pochází z vody a kyslík v uvolňované vodě z oxidu uhličitého.
Podstatou procesu je redukce oxidu uhličitého na glukosu, za využití světelné energie poutané v ATP (adenosintrifosfát) a NADPH (redukovaný nikotinamiddinukleotidfosfát).)
Proces fotosyntezy probíhá ve specializovaných organelách: chloroplastech
Chloroplasty: obsahují systém vnitřních membrán nazývaných thylakoidy.
Tyto uzavřené membrány stupňovitě na sebe naskládané tvoří grana
obkopená základní hmotou zvanou stroma. V granech jsou umístěny oba fotosystémy
I. a II.. Chlorofyl je rozmístěn v membránách gran, mezi vnější bílkovinovou
a vnitřní lipidovou vrstvou.
Chlorofyly jsou tvořeny 4 pyrolovými jádry vázanými na centrální atom hořčíku.
Rostliny mohou využívat spektrum v rozsahu 400 - 750 nm:
- chlorofyly a a b zachycují modrofialové a červené části spektra
- fykocyanin a fykoerytrin (barviva vyskytující se u řas) zelené a žluté světlo
- xantofyly a karotenoidy modrozelenou část spektra
1. Světelná fáze fotosyntézy:
Probíhá ve fotosyntetickém aparátu fotosystémů I. a II. Tyto fotosystémy jsou složeném z tzv. světlosběrných (anténních) komplexů tvořených pigmenty (zejména chlorofyl). Lze si je představit jako nálevky, obsahující jako hlavní složky stovky (asi 300) molekuly chlorofylu a a b , které usměrňují energii fotonů k reakčnímu centru fotosystémů- molekulám a1 a a2. Ty pak mohou fotochemicky reagovat a odevzdávají elektron na další vhodný akceptor. Dále se skládají z návazného systému přenašečů elektronů, které ve výsledné fázi vedou k tvorbě energetických sloučenin ATP a NADPH.Navzájem se fotosystémy podobají celkovou stavbou a liší v optimální vlnové délce, kterou absorbují a sytému přenašečů a tím i produktů na sebe návazných reakcí.
Fotosystém I
Elektron uvolnění z reakčního centra nálevkovitého komplexu (molekula reakčního centra má v klidu +0,45V, v excitovaném stavu - 0,55V ),
je předán na ferredoxin (redukční činidlo), ferredoxin pak redukuje NADP+ na NADPH
Protony potřebné k redukci pocházejí z fotolýzy vody, spřažené s fotosystémem II.
Alternativní cestou je tvorba ATP - cyklický transport
(cyklický proto, že původně excitovaný (elektron přejde na hladinu s vyšší
energií a získá zápornější redoxní potenciál) a postupně přenášený elektron se
po vrací zpět do centra fotosystému.
Fotosystém II Elektron uvolněný z reakčního centra (reakční centrum s nábojem +0,82V a v excitovaném stavu 0V). je přenášen na silné oxidační činidlo, které uvolňuje kyslík z vody při její fotolýze. Uvolněnou energií a vodíkem se redukuje NADP na NADPH+ +H+ + 1/202. Absorpcí fotonů doplňuje fotosystém II elektronové mezery ve fotosystému I a přivádí jej zpět do původního redukovaného stavu. Stav fotosystému II se znovu obnovuje díky elektronům uvolněným při fotolýze vody
H2O------2H+ + 2e- + 1/2 O2
Tento necyklický tok elektronů se nazývá necyklická fosforylace.
2. Temnostní fáze fotosyntézy - Calvinův cyklus:
Probíhá paralelně s fází světelnou (není vázána na tmu!, ale na energetické produkty světelné fáze)
molekuly ATP a NADPH, vkteré využívá k redukci CO2
a zabudování uhlíku do molekuly glukosy.
Zároveň v ní dochází k regeneraci prvotního akceptoru CO2 - ribulosa 1,5 bifosfátu.
Jde v podstatě o Calvinuv cyklus a tedy syntézu glukózy z oxidu uhličitého a
vody. Je potřeba si uvědomit že v rámci jednoho cyklu je navázáno 6 molekul CO2, vzniká 12 tříuhlíkatých řetězců a vytváří se jedna molekula šestiuhlíkaté glukózy.
Zabudováním CO2 (přijatého průduchy ze vzduchu) do primárního
řetězce ve vazbě na primární akceptor ribulosa 1,5 bifosfát.
Vzniká labilní šestiuhlíkatý meziprodukt a poté dvě molekuly 3- fosfoglycerové kyseliny
(jako katalyzátory reakce potřeba Mg a Cu).
Redukcí vzniká fosforglyceraldehyd (spotřeba 2 ATP) a 2 NADPH a dále
probíhají reakce s cílem regenerace původního ribulosa 1,5 bifosfátu
(ke katalýze potřeba Mg a Mn)
C4-cyklus: Hatch - Slackův cyklus
je variantou Calvinova cyklu a další možností zabudování CO2 do uhlíkatého řetězce.
Používají ho především tropické rostliny.
Rozdíl je v tom, že prvotním akceptorem CO2 je fosfoenolpyruvát
a prvotními produkty je malát, aspartát a oxalacetát.
Uhlík z těchto meziproduktů je pak přenesen na ribulosa 1,5 bifosfát
a přes 3- fosfoglycerovou kyselinu probíhají reakce dále stejně jako u Calvinova cyklu.
Fosfoenolpyruvát má několikanásobně větší afinitu k CO2 než
ribulosa 1,5 bifosfát. Což umožňuje fotosyntézu i při nižším množství
CO2 ve vzduchu a při omezeném příjmu vody, ale je potřeba vyšší intenzita slunečního záření.
Další výhodou tohoto způsobu je větší efektivita fixace a menší ztráty při fotorespiraci a tím intenzivnější tvorba rostlinné hmoty.
Syntéza mastných kyselin
Je proces probíhající v cytoplazmě, vyžadující značné množství energie ve formě ATP a katalýzu. Probíhá díky vazbě Acetylkoenzymu A přes S na acyl.
8 CH3CO-S-CoA(acetylkoenzym A)+ 7 ATP + 14 NADPH + H2O --->
---> CH3(CH2)14COOH + 8 CoA-SH + 14 NADP + 7 ADP + 7 fosfátových zbytků
Syntéza bílkovin
Je proces probíhající na ribozómech, vázaných na endoplazmatické retikulum (v těsné blízkosti buněčného jádra). Podílí se na něm jak informace z jaderné DNA (ve formě mediátorové RNA), tak prostředí ribozómu (tvořeného ribozomální RNA)a molekuly transferové RNA nesoucí jednotlivé aminokyseliny. Podle pořadí dusíkatých bazí v mRNA je komplementárně utvářeno pořadí tripletů tRNA nesoucích specifické aminokyseliny, čímž dochází k určení přesného pořadí aminokyselin ve vznikajícím bílkovinném řetězci.
Je to dvoustupňový proces transkripce a translace .
Transkripce
Je to děj probíhající v jádře, podobný procesu replikace nukleových kyselin, nicméně přepsána je jen část řetězce DNA do RNA. Tj přepisuje se pořadí komplementárních nukleotidů (C-G, A-T). Je katalyzovaný RNA-polymerasou , cukerná složka je ribóza (místo deoxyribózy v DNA) a místo báze thyminu je zabudováván uracil.
Translace
Probíhá v cytoplazmě ve vazbě na ribozómy drsného endoplazmatického retikula. Začíná vazbou mRNA na ribozóm a připojením prvních dvou molekul transferové RNA nesoucích aminokyselny, přičemž vždy trojici bazí na mRNA (kodónu)odpovídá komplementárně trojice bazí tRNA (antikodón). Nejprve vzniká dipeptid, vázaný na druhé tRNA a první se uvolňuje za současné vazby třetí molekuly tRNA.
Odbourávání zásobních látek - respirace
Je proces umožňující využívat energii poutanou v zásobních látkách. Podstatou procesu je štěpení vazeb uhlíkatých řetězců oxidací- kyslíkem. Uvolněná energie je využta na tvorbu fosfátové vazby ATP (z ADP). Vedlejším produktem je voda. Tento proces probíhá v membránách mitochondrií.
Sestává ze tří fází:
- Oxidace substrátu za současného přenosu vodíku dehydrogenázami na NADH a FADH.
- Vodík z NADH přenášen na kyslík (v rámci dýchacího řetězce tvořeného systémem cytochromů) a vzniká voda.
- Třetí fází je aerobní fosforylace - tvorba ATP
Na každý pár elektronů, který projde dýchacím (respiračním) řetězcem (1 molekula NADH), se mohou vytvořit 3 molekuly ATP.
Aerobní rozklad cukrů
Úplná oxidace glukosy až na oxid uhličitý se dá souhrnně napsat jako převrácená rovnice fotosyntézy, ovšem je třeba brát v úvahu to, že se jedná o mnohastupňový proces, jehož jednotlivé části s fotosyntézou nemají nic společného! Úplným rozkladem glukosy se uvolní energie na tvorbu 38 molekul ATP.
- Glykolýza: šestiuhlíkatá glukosa se mení na tříuhlíkatý pyruvát, což je proces který probíhá v cytoplazmě a začíná fosforylací molekul glukosy (nejprve spotřebovány, pak vznikají 2 ATP).
- Pyruvát se oxiduje na Acetylkoenzym A, což je proces robíhající v mitochondriích, je katalyzován řadou enzymů a jehož podstatou je oxidační dekaboxylace pyruvátu
- Acetylkoenzym A se v rámci citrátového cyklu oxiduje na oxid uhličitý a vodu. Počátek cyklu je ve vazbě acetylkoenzymu A(C2)na oxalacetát (C4)a vznik citrátu. Dvoustupňovou oxidací a uvolněním dvou uhlíků ve formě oxidu uhličitého se obnovuje oxalacetát.
Anaerobní rozklad cukrů
Je proces, který probíhá za nedostatku kyslíku. V tomto případě nemůže být vodík (z redukovaných NADPH a FADH) přenášen na kyslík za vzniku vody a z reakcí obdobných aerobním probíhá pouze glykolýza (jako zdroj energie pro tvorbu ATP). Glukoza je tedy odbourávána pouze na pyruvát a k obnově oxidovaného NADH dochází vazbou vodíku na pyruvát a tvorbou laktátu (kyseliny mléčné) . Tento proces se nazývá mléčné kvašení (tvorba 2 molekul ATP). Další možností - např pro kvasinky - je alkoholové kvašení - odštěpením oxidu uhličitého z pyruvátu vzniká acetaldehyd a ten je teprve redukován NADH. Konečným produktem této reakce je ethanol.
V živých organismech nejprve dochází k odbourávání glukosy, glykogenu (u savců) a teprve při jeho výraznějším odčerpání k odbourávání lipidů.
Beta-oxidace mastných kyselin
Lipidy v organismu mají funci zásobních látek pro uchování energie (acylglyceroly, triacylglyceroly nejčastěji), ale jsou zároveň stavební součástí buněčných membrán (fosfolipidy, glykolipidy), chrání orgány atd.
Štěpení tuků probíhá díky enzymu lipase a jeho první fází je štěpení tuků na mastné kyseliny a glycerol, další fází je beta-oxidace mastných kyselin, která probíhá v mitochondriích. Je to opět několikastupňový proces katalyzovaný enzymy, v jehož rámci dochází k vazbě acylu (R-COOH) na acetylkoenzym A a postupném zkracování acylového zbytku na acetylkoenzymu (oxidací a uvolnění oxidu uhličitého).Meziprodukty reakce: Acetylkoenzym A může být dále oxidován v citrátovém cyklu, FADH a NADH může předávat vodík v dýchacím řetězci. Úplným rozštěpením 1 molekuly kyseliny palmitové (C16)se uvolní energie pro tvorbu 129 molekul ATP.
Základní separační metody
Metody, umožňující oddělení látek, nebo jejich získání v čistém stavu.
Extrakce Vyluhování- proces separace látek ze směsi (pevné nebo kapalné) , na základě jejich rozdílné rozpustnosti v rozpouštědle. Čistá látka se pak získá odpařením rozpouštědla (v případě kapaliny destilací).
Krystalizace Je založena na rozdílnosti rozpustnosti při určité teplotě (jedna látka rozpustná, druhá nikoli- při ochlazování směsi vykrystalizuje).
Destilace Založena na rozdílné teplotě varu dvou složek kapalné směsi. Při zahřívání těká dříve látka s nižším bodem varu- je odváděna a po ochlazení kondenzuje (kapalní).
Sublimace Odpařování pevných látek- sublimace při nižších teplotách než je bod varu (jod, chlorid amonný, chlorid rtuťnatý).
Chromatografie Oddělení složek směsi látek s různou rozpustností, velikostí částic, chemicku afinitou, hmotností částic, elektronegativitou…).Použito je rozpouštědlo, pohybující se spolu se složkami směsi podél nosiče (stacionární) fáze- adsorpční materiál, gel. Při pohybu směsi dochází k oddělení složek na základě různé rychlosti pohybu různých molekul (ovlivněno velikostí molekul, různým nábojem a tím i různou rychlostí a směrem pohybu v el. poli, rozpustnost v rozpouštědle, rozdílná adsorpce na pevnou fázi…).
Metody hodnocení struktury látek
Spektroskopické metody- založeny na interakci elektromagnetického záření a zkoumané látky (např. absorpce), hmotností spektrometrie, difrakce rentgenového záření.
Spektroskopie – (infračervená oblast, ultrafialová oblast, viditelná část spektra) Při průchodu elektromagnetického záření vzorkem, dochází k pohlcování tohoto záření v určitých vlnových délkách (absorpční spektra). Tato spektra závisí na energetickém stavu molekuly- a ukazuje přítomnost charakteristických skupin v molekule, a její prostorové uspořádání (IČ), vícenásobné vazby, aromatický charakter molekuly, přechody valenčních elektronů do vyšších vrstev (Uv, viditelné záření).
Hmotnostní spektrometrie Ionizace plynného vzorku svazkem letících elektronů. Směs kationtů se pak v elktrickém poli urychluje a v silném magnetickém poli se v souvislosti s jejich nábojem mění jejich trajektorie. Plynule se mění urychlující napětí a výsledkem je hmotnostní spektrum iontů ze kterého lze odhadovat strukturu původních molekul.
Nukleární magnetická rezonance Opět založena na absorpci elektromagnetického záření (ca 100MHz), při průběžné změně kmitočtu nebo indukce magnetického pole dochází k adsorpci při změnách energie atomových jader (v souvislosti s jejich orientací v magnet. poli). V případě atomů vodíku- protonová magnetická rezonance.
Difrakce rentgenového záření Při průchodu rentgenového záření krystaly vzorku dochází k rozptylu a interferenci záření na krystalové mřížce (vlnová délka podobná vzdálenostem atomů v mřížce).Ukazuje prostorové uspořádání atomů a iontů v molekulách a krystalech, délku vazeb, vazebné úhly.
Literatura použitá a doporučená:
- Čtrnáctová H. a kol, 1998.: Chemie pro 8. ročnik ZŠ, SPN, Praha. 230 s.
- Jursík F. 2002: Anorganická chemie kovů: http://vydavatelstvi.vscht.cz/knihy/uid_isbn-80-7080-504-8/pages-img/obsah.html
- Jursík F. 2002: Anorganická chemie nekovů: http://vydavatelstvi.vscht.cz/knihy/uid_isbn-80-7080-417-3/pages-img/
- Šebánek J.a kol.1983: Fyziologie rostlin. 1. vyd. Praha: Státní zemědělské nakladatelství 151 s.
- Vacík J. a kol.,1995: Přehled středoškolské chemie. SPN- Pedagogické nakladatelství a.s., 365 s.
- Vodrážka Z. 1993: Biochemie 3. Academia, Praha. 320 s.
- Voet D., Voetová J.,1995: Biochemie. 1. čes. vyd. Victoria Publishing a.s., Praha 430 s.
Bližší a podrobnější snadno dostupné informace k tématům najdete například zde:
- Atom: http://cs.wikipedia.org/wiki/Atom
- Mendělejevova tabulka: http://cs.wikipedia.org/wiki/Periodická_tabulka
http://www.ptable.com
http://www.prvky.com/periodicka-tabulka.html - Chemické reakce: http://cs.wikipedia.org/wiki/Chemická_kinetika
http://cs.wikipedia.org/wiki/Chemická_reakce
http://cs.wikipedia.org/wiki/Katalyzátor - Enzymy: http://cs.wikipedia.org/wiki/Enzym
- Fotosyntéza: http://cs.wikipedia.org/wiki/Fotosyntéza
- Buněčné dýchání: http://cs.wikipedia.org/wiki/Buněčné_dýchání
- Vitamíny: http://cs.wikipedia.org/wiki/Vitamín